MODULO:
APARATO CARDIOVASCULAR
CICLO ll DE LA CARRERA DE MEDICINA
M.C. MARIO MARTINEZ ROBLES
Q.F.B CLAUDIA MARTINEZ CARRERA
“El conocimiento
científico es patrimonio Universal “
Un agradecimiento especial para Fernando
Gabriel Ranea por su autorización desde Buenos Aires, Argentina, para el uso de
las imágenes de sus páginas de internet fgranea@microbiología.com.ar y http://www.microbiologia.org.ar de
manera gratuita para la elaboración de este material de apoyo didáctico para
los estudiantes Universitarios.
M.C. Mario Martínez Robles.
Profesor de Asignatura A definitivo.
Microbiología y Clínicas médicas.
Facultad de Estudios Superiores Zaragoza UNAM.
MéxIco D.F., a 20 de julio 2016.
l
ÍNDICE
|
Pags.
|
Reacciones
febriles (Práctica No. 10)
|
128
|
Objetivos
|
128
|
Género Salmonella
clasificación.
|
129
|
Morfología y
medios de cultivo para Salmonellas.
|
130
|
Género Brucella.
|
131
|
Características
morfológicas del género Brucella .
|
132
|
Género Proteus,
morfología y clasificación .
|
132
|
Género Ricketsiae morfología.
|
133
|
Ricketsias, antígenos y enfermedades.
|
133
|
Técnica para la
recolección de la muestra de sangre.
|
134
|
Método
de aglutinación rápida en placa.
|
135
|
Títulación del
suero e interpretación de resultados.
|
135
|
Método de
aglutinación en tubo títulación
y resultados.
|
137
|
Reacciones
positivas, títulos para Salmonellas, Brucellas y Rickettsias
|
137
|
Cuestionario.
|
138
|
Paludismo
(Práctica No. 11).
|
139
|
Objetivos.
|
139
|
Clasificación
del género Plasmodium.
|
140
|
Ciclo vital de
las especies del género
Plasmodium.
|
141
|
Plasmodium
falciparum, Paludismo terciano maligno.
|
143
|
Plasmodium
falciparum, esquizontes
eritrocitarios y trofozoítos.
|
144
|
Plasmodium vivax paludismo terciano benigno.
|
145
|
Plasmodium vivax esquizontes maduros y
trozoítos.
|
145
|
Plasmodium ovale esquizontes maduros, merozoítos y trozoítos.
|
146
|
Plasmodium
malarie Paludismo cuartano.
|
146
|
Plasmodium
malarie esquizontes y merozopitos.
|
146
|
Coloración de
Giemsa.
|
150
|
Extendidos
delgados y gruesos.
|
152
|
Cuestionario.
|
152
|
Tripanosomiasis
(Práctica No, 12).
|
153
|
Objetivos.
|
153
|
Clasificación
del género Tripanosoma
|
154
|
Ciclo biológico.
|
157
|
Morfología e
identificación.
|
158
|
Métodos de
diagnóstico.
|
160
|
Cuestionario.
|
160
|
Hemocultivo
(Práctica No. 13).
|
161
|
Objetivos.
|
161
|
ll
INDICE
|
Pags.
|
Septicemia
y shock séptico, agentes etiológicos
|
162
|
Toma de la
muestra de sangre para el hemocultivo
|
163
|
Método de
siembra en el medio Ruiz Castañeda..
|
167
|
Interpretación
de resultados en medios sólidos y líquidos
|
167
|
Cuestionario.
|
168
|
Resiembra en
medios selectivos (Práctica No. 14).
|
169
|
Objetivos.
|
169
|
Agar S-110, Agar
Sal manitol para Staphylococcus aureus
|
170
|
Agar sangre de
carnero para Streptococcus y Diplococcus.
|
171
|
Agar chocolate para el
aislamiento de Haemophylus influenzae
|
171
|
Agar Sabouraud
glucosado para el aislamiento de hongos
|
171
|
EMB, Agar Mac
Conkey, SS, aislamiento de Enterobacteriaceae.
|
172
|
Método de
siembra en medios selectivos.
|
172
|
Cuestionario.
|
175
|
Identificación
por pruebas bioquímicas (práctica No. 15)
|
175
|
Objetivos.
|
175
|
Tinción de Gram
y morfología colonial para la elección de los medios.
|
176
|
Pruebas para la identificación del género Streptococcus.
|
176
|
Pruebas para la
identificación de Staphylococcus aureus.
|
177
|
Pruebas para la
identificación de Streptococcus pneumoniae.
|
177
|
Pruebas para la
identificación de Haemophylus
influenzae.
|
178
|
Identificación de Géneros y especies de Enterobacteriaceae.
|
178
|
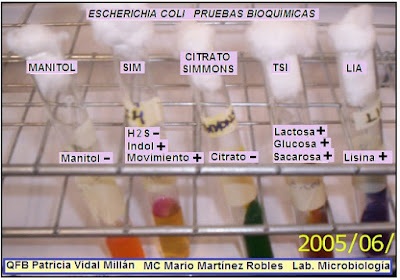
Fundamento del
uso de Azúcares como pruebas bioquímicas en TSI.
|
180
|
Fundamento de la producción de ácido
sulfhídrico (H2S) SIM.
|
181
|
Fundamento de la
producción de
Indol en SIM.
|
182
|
LIA .- Técnica
de siembra y descarboxilación de la lisina.
|
183
|
LIA.- Producción
de sulfuro ferroso
|
184
|
Técnica de
siembra y fundamentos bioquímicos en MIO
|
184
|
Técnica de
siembra y fundamentos bioquímicos en Citrato de Simmons
|
186
|
Técnica de
siembra y fundamentos bioquímicos en urea de Christian.
|
187
|
Material para el
desarrollo de la práctica
|
188
|
Cuadro de
pruebas bioquímicas de la familia Enterobacteriaceae.
|
190
|
Resultado de
pruebas con el Género Salmonella,
en Imágenes.
|
191
|
Resultado de
pruebas con el Género Escherichoa coli,
en Imágenes.
|
191
|
Resultado de
pruebas con el Género Proteus, en Imágenes.
|
192
|
Cuestionario.
|
192
|
Bibliolgrafía.
|
128
Práctica No. 10
REACCIONES FEBRILES
OBJETIVOS
1.- El alumno conocerá las características morfológicas
de las especies patógenas de los géneros Salmonella, Brucella, Proteus
y Rickettsia.
2.- El alumno conocerá los antígenos
específicos identificables por pruebas serológicas, de los géneros Salmonella,
Brucella, Proteus y Rickettsia.
3.- El alumno conocerá la importancia de las
pruebas serológicas para el diagnóstico de las enfermedades producidas por los
géneros Salmonella, Brucella, Proteus y Rickettsia.
4.- El alumno conocerá la importancia del uso
de antígenos del Génerp Proteus para el diagnóstico de las enfermedades
producidas por el género Rickettsia.
5.- El alumno conocerá los métodos para la
aglutinación en placa y en tubos.
6.-
El alumno conocerá la técnica para la toma de la muestra del suero.
7.- El alumno aplicará la técnica para la
prueba de aglutinación en placa.
8.- El alumno el alumno aplicará la técnica
para la interpretación de resultados en placas.
9.- El alumno
aplicara la técnica para la prueba de aglutinación en tubos.
10.- El alumno el alumno aplicará la técnica para
la interpretación de resultados.
129
REACCIONES
FEBRILES
SALMONELLAS
Las Salmonellas son bacterias, móviles, anaerobias facultativas, en forma de bacilos Gram negativos
clasificadas dentro de la familia Enterobacteriaceae,
frecuentemente son patógenas para el hombre y animales produciendo
enteritis, infección generalizada y fiebres intestinales.
La clasificación del género Salmonella hasta 1983, hacía
referencia a un solo género con 3
especies:
Salmonella typhi (1 serotipo)
Salmonella
cholerae suis (1
serotipo)
Salmonella enteritidis (más de 1500 serotipos.
Posteriormente se ha designado a
este género, el nombre de Salmonella
que incluye a una sola especie, Arizona (Salmonella
= género, Arizona = especie) con seis
subespecies, clasificadas en el estudio de ADN. Sin embargo, los reportes de
laboratorio, designan a las Salmonellas
con el nombre del género utilizando el nombre de la especie con la nonmeclatura
anterior, adicionando o no el serogrupo, por lo que la aceptación del serogrupo
no ha sido aceptada del todo.
Existe una clasificación
ecológica de acuerdo a la adaptación y preferencia de las Salmonellas por las
especies animales que le sirven de
huésped o reservorio:
GRUPO A: Serotipos adaptados al hombre.
Salmonella
typhi, S. parathyphi B, S. hirschfeldi y S.
sendai. No
tienen reservorio zoonótico, la infección de los animales es rara y accidental,
el hombre es el único reservorio. La fuente de infección son las heces de
personas infectadas.
A causa de su importancia clínica, deben
identificarse tres especies:
S. Typhi, S.
choleraesius y S. Paratyphi A.
GRUPO B: Serotipos muy adaptados a huéspedes
no humanos.
Salmonella pollorum, S. dublin, S. abortus, S. ovis, S.
typhisis, S. gallinarum, S. abortusequi, y S. cholerae suis, iinfectan
a pollos, gallinas, reses, caballos, carneros y cerdos. S. dublin y S. cholerae suis esporádicamente causan infección en el
hombre.
130
GRUPO C.- Serotipos no adaptados a huéspedes
específicos. Más de 1,700 serotipos, producen en el humano gastroenteritis de
corta duración, con un periodo de incubación corto, raramente invaden la
sangre, la fuente de infección al hombre son las heces de animales, del hombre
y productos alimenticios (huevos, carne,
leche y otros productos lácteos infectados).
Morfología
Las Salmonellas son bacilos
rectos Gram negativos, de 0.7
a 1.5 micras de diámetro por 2 a 5 de largo, móviles por
tener flagelos perítricos, anaerobios facultativos, fermentan la glucosa con
producción de gas, no fermentan lactosa, la producción de Indol es variable (Positivo
o negativo según especie), producen sulfuro de hidrógeno, descarboxilan la
lisina y ornitina, reducen nitratos a nitritos, el citrato comúnmente es
utilizado como única fuente de carbono y son ureasa negativas.
Medios de cultivo
El Agar con Eosina y Azul de metileno es útil
para el aislamiento de los bacilos entéricos Gram negativos. El colorante Azul de metileno inhibe el crecimiento de
Gram positivos. El Agar de Mac Conkey también se puede
usar para el aislamiento de organismos coniformes Gram negativos. El colorante
violeta cristal y las sales biliares que contiene el medio inhiben el
crecimiento de bacterias Gram positivas,
Estructuras
antigénicas
Aunque las especies del género Salmonellas se identifican, inicialmente por sus características
bioquímicas, también es posible su identifican
mediante análisis antigénico
(pruebas serológicas) o reacciones febriles.
Las Salmonellas poseen diversos
antígenos O y
diferentes antígenos H en una o ambas fases. Algunas Salmonellas cuentan con antígenos capsulares (K),
conocidos como de virulencia (Vi), que pueden producir una reacción de
aglutinación por antisueros O y
que se relacionan con la infección
activa o anterior por alguna especie de Salmonella.
Antígenos O.- Constituyen la parte más externa de los lipopolisacáridos de la pared
celular, consisten en unidades
repetidas de polisacáridos. Algunos
polisacáridos O específicos contienen
azúcares únicos. Los anticuerpos contra
los antígenos O son, de manera predominante Ig M. Antígenos K.-
Son externos en relación con los
antígenos O algunos son polisacáridos, otros son
proteínas. Los antígenos K pueden relacionarse con la virulencia.
131
Antígenos H.- Están localizados
sobre los flagelos, el calor y el alcohol
los desnaturaliza o eliminan. Estos antígenos H se aglutinan con anticuerpos
anti H, principalmente del tipo Ig G. Los aspectos determinantes de los
antígenos H son una función de la secuencia de los aminoácidos de la proteína flagelar (flagelina).
Identificación de Salmonellas
por métodos serológicos
Prueba de aglutinación en
placa.- Para esta prueba se utiliza el suero del paciente y antígenos conocidos
de Salmonellas. La aglutinación se
produce en unos cuantos minutos, es una
prueba para la Identificación preliminar
rápida de especies.
Prueba de aglutinación por
dilución en tubo (prueba de Widal).- Las aglutininas séricas aumenten durante
la segunda y tercera semana de
infección. Son necesarias dos muestras de suero en intervalo de siete a diez
días para comprobar aumento de anticuerpos. Se utilizan el suero del paciente y
antígenos conocidos de Salmonellas.
El
género Brucella, descrito en 1920 por
Meyer y Shaw, está formado por bacterias parásitas intracelulares facultativas,
que producen el aborto en muchas especies domésticas de animales y enfermedades
febriles, septicémica o infecciones focalizadas en el hombre. El descubrimiento
del agente etiológico de la enfermedad, conocida como fiebre de Malta, se
realizó a finales del siglo XIX, por un grupo de investigadores encabezados por
D. Bruce. Con base en las características coloniales y microscópicas, la
bacteria se denominó Micrococcus
mellitensis.
Las Brucellas
tienen preferencia marcada por el huésped animal, así se tiene que B. abortus infecta normalmente al ganado
bovino, B. mellitensis se relaciona
mas con cabras y borregos, B. suis
con cerdos, B. canis infecta perros, B. ovis causa infección específicamente
a borregos y B. neotomae a roedores.
El hombre es susceptible a cualquiera de las cuatro primeras especies.
La brucelosis es una enfermedad que se adquiere al ingerir
leche o queso no pasteurizados o a través de la piel que se pone en contacto
con secreciones de animales contaminados. Las Brucellas se diseminan por vía hemática y linfática.
En
los ganglios linfáticos, hígado, bazo, médula ósea y otros tejidos desarrollan
nódulos granulomatosos en forma de abscesos.
132
La
enfermedad aguda o crónica se manifiesta principalmente por escalofríos,
mialgias, artralgias, debilidad ocasionando postración. Los episodios febriles
en pico de predominio vespertino culminan con diaforesis profusa lo que ha dado
lugar al nombre de fiebre ondulante. El deterioro meníngeo, encefálico,
renal y
hepático peden terminar con la vida del enfermo.
Morfología microscópica
Las Brucellas son bacilos cortos pequeños Gram
negativos de 0.5 X 0.5 hasta 1.5 micras de longitud, al emplear la tinción de
Zielh-Neelsen modificada, las Brucellas se tiñen de color rojo. Otras
bacterias se verán verdes.
Bacterias Gram negativas de la
familia Enterobactereaceae, son
bacilos de 0.4 a
0.8 micras de diámetro por 3 micras de longitud, móviles por flagelos
perítricos, hidrolizan la urea,
producen ácido sulfhídrico H2S
y otros ácidos a partir de mono y disacáridos. Las especies del género Proteus
forman parte de la flora normal del intestino del hombre, sin embargo, son
oportunistas capaces de producir enfermedades diarreicas, infecciones
urinarias, neumonía, septicemia y muerte en pacientes debilitados. El género Proteus
comprende cuatro especies:
Proteus vulgaris, Proteus
mirabilis, Proteus myxofaciens,
Proteus pennen
133
Estructuras
antigénicas
El género Proteus a semejanza del resto de los miembros de la familia Eneterobactreaceae, presenta antígenos somáticos de los cuales se
reconocen 17 para P. Vulgaris, 27
para P mirabilis y otros 5
compartidos por ambas especies, en tanto que los antígenos flagelares (H) son
19.
La reacción cruzada que
presentan estas bacterias son frecuentes por lo que la prueba de antígenos
flagelares ocupados en la diferenciación es limitado. El antígeno capsular (k)
designado como antígeno C ha sido demostrado en las especies de P. vulgaris y P. mirabiilis. En las otras dos especies no ha sido examinado.
RICKETSIAS
Las Ricketsias son
bacterias pleomórficas que pueden tener forma de coco o de bacilos, son azules
a la tinción de Giemsa, miden 400 milésimas de micra aproximadamente, se
localizan intracelularmente y solo pueden ser cultivadas en células vivas,
hecho que dificulta su identificación, sin embargo las Rcketsias que
causan enfermedades febriles en el hombre, tienen componentes antigénicos idénticos a los del género Proteus (antígenos OX-19, OX-2, OX-K),
esta relación se utiliza para el diagnóstico del tifo, enfermedad causada por
Rcketsias, en la prueba de Weil-Félix.
Las
infecciones por Ricketsias se caracterizan por producir signos y síntomas como
malestar general, cefalea, fiebre de hasta dos semanas o crónica, postración,
exantemas, úlceras, escaras,
hepatomegalia y esplenomegalia.
El tifo endémico es grave y con frecuencia mortal. La fiebre manchada
como la fiebre de las montañas
Rocallosas, la fiebre del Mediterráneo y la fiebre Brasileña varían en su
severidad, en ancianos pueden ser mortales.
La
inmunidad por lo general es de larga duración, con algunas excepciones: (1) el
tifus endémico puede causar recaídas 10-20 años después de la aparente
recuperación (enfermedad de Brill Zinsuer), (2) la fiebre de las trincheras se
caracteriza por las recaídas.
134
REACCIONES FEBRILES
Son reacciones de
aglutinación entre los antígenos (Salmonella,
Brucella y Proteus OX-19) y los anticuerpos contra estos antígenos
presentes en el suero del paciente.
Contenido del equipo
1.- Frasco gotero
con tapón de rosca conteniendo 5 ml de antígeno “O” (Somático 9, 12) de Salmonella typhi.
1.- Frasco gotero con tapón de rosca conteniendo 5
ml de antígeno “H” (Flagelar s) de Salmonella
typhi.
1.- Frasco gotero con tapón de rosca conteniendo 5
ml de antígeno flagelar “ Paratyphi A”.
1.- Frasco gotero con tapón de rosca conteniendo 5
ml de antígeno (flagelar b, 1,2) “ Paratyphi B”.
1.- Frasco gotero con tapón de rosca conteniendo 5
ml de antígeno “Brucella” Brucella abortus.
1.- Frasco gotero con tapón de rosca conteniendo 5
ml de antígeno “Proteus OX-19” .
1.- Frasco gotero con tapón de rosca conteniendo 2
ml o 5 ml de control positivo.
1.- Frasco gotero con tapón de rosca conteniendo 2
ml o 5 ml de control negativo.
Material y equipo
necesario adicional:
Agitador de placas
Placas
de vidrio con divisiones
Aplicadores
Recolección y
manejo de las muestras
La
sangre se colecta por punción venosa con los cuidados pertinentes de
antisepsia, 3 ml de sangre son suficientes, se deja coagular y se separa el
suero por centrifugación a 2,500 r.p.m. durante 5 minutos. Cuidar el balance
del peso de los tubos de ensaye para mantener el equilibrio en la centrífuga.
135
MÉTODO DE AGLUTINACIÓN RÁPIDA EN PLACA
1.-
Utilizar de preferencia una placa de vidrio marcada con 5 hileras de 6 cuadros.
2.-
Anotar el antígeno que le corresponde a cada serie.
3.-
Depositar en los cuadros de cada serie 0.08, 0.04, 0.02, 0.01 y 0.005 ml de
suero del paciente de izquierda a derecha.
4.-
Agregar una gota de antígeno en cada una de las cantidades de suero.
5.-
Mezclar con un aplicador limpio,
comenzando con la última dilución de la derecha y siguiendo con las restantes
de la izquierda (utilizar un aplicador por cada serie).
6.-
Agitar suavemente la placa por rotación (120 r.p.m.) durante 2 a 3 minutos
7.-
Leer con luz indirecta.
Controles.- Para el
método de aglutinación rápida en placa el control positivo tiene un título
mínimo de 1:80 con cualquiera de los antígenos.
Control negativo.-
No debe mostrar aglutinación con ninguno de los antígenos.
Interpretación de los
resultados
Método de
aglutinación rápida en placa. Se observa la aglutinación macroscópica y se
valoran los resultados en la siguiente forma.
Grado de
aglutinación
100% 4 +
75% 3+
50% 2+
25% +
0 --
El punto final de
la aglutinación será la máxima dilución del suero que muestra una aglutinación
de 2+
Ejemplo:
Suero (ml) 0.08 0.04
0.02 0.01 0.005
Aglutinación 4+ 4+ 3+ 2+
Titulo
correspondiente 1/20 1/40
1/80 1/160 1/320
Resultado: Una
titulación positiva de 1/160 indica una gran probabilidad de enfermedad activa,
la titulación deberá repetirse a la
semana, mientras tanto, los estudios complementarios como hemocultivo, tinción
de Giemsa, etc. Confirmarán el diagnóstico y reorientarán el tratamiento.
136
MÉTODO
DE AGLUTINACIÓN EN TUBO
1.-
Numerar 7 tubos (12 x 75 mm )
del 1 al 6 y un testigo (T) para cada antígeno.
2.-
Adicionar 0.9 ml de solución salina al primero y 0.5 ml a los restantes.
3.-
Agregar 0.1ml del suero problema al tubo 1 que ahora tendrá 1 ml., mezclar la
suspensión y extraer 0.5 ml., para
pasarlos al tubo 2, quedando solo
0.5 ml., en el tubo número 1.
4.-
El tubo número 2, ahora con 1 ml., de la suspensión deberá mezclarse para
después extraerle 0.5 ml., que serán adicionados al tubo número 3.
5.-
Así sucesivamente hasta el tubo 6, eliminando los 0.5 ml restantes de esta
última dilución.
6.-
De esta forma se obtienen diluciones
1/10, 1/20, 1/40, 1/80, 1/160 y 1/320, del suero problema en solución salina.
7.-
Adicionar 0.5 ml de antígeno diluido previamente 1.20 con solución salina en
cada uno de los tubos.
5.- Agitar
enérgicamente e incubar en baño maría en las siguientes condiciones:
Antígeno Temperatura Tiempo
Salmonella “O” 48-50”C 18 a 24 horas
Salmonella “H” 37°C 2 horas
Paratíficos “A” y “B” 48-50°C 2 horas
Brucella 37°C 48 horas
Proteus OX-19 37°C 18 horas
Resultados del método de aglutinación en tubo
Observar los tubos
testigos que no deben mostrar aglutinación, tomar 2 o 3 tubos a la vez,
agitarlos ligeramente frente a una fuente de luz que ilumine las partículas
claramente.
Reportar al título
del suero, empleando la reciproca de la dilución más alta, que da una
aglutinación de 2 +.
Hacer las lecturas
en la siguiente forma:
Grado de
aglutinación
100% ++++
Sedimentación de los grumos y el sobrenadante claro.
75% +++ Grumos
sedimentados casi totalmente y sobrenadante claro.
50% ++
Sedimentación marcada y sobrenadante ligeramente claro.
Negativo. Ninguna evidencia de aglutinación,
sobrenadante idéntico al control.
137
Salmonella.- El método en placa
es una prueba de escrutinio y debe considerarse como tal, ya que la prueba de
Widal está sujeta a gran número de variables, los resultados dependerán del
estado de la enfermedad y del aumento en el título solo en la segunda semana de
la enfermedad.
El
nivel “normal” de aglutininas variará en diferentes poblaciones y
circunstancias; por ejemplo los adictos a los narcóticos tienen niveles más
elevados de anticuerpos S. typhi O y
H. La terapia antimicrobiana retardará
el aumento de titulo, y la inmunización previa incrementará los anticuerpos O y
H, o también puede aumentar en cualquier periodo febril. El concepto de titulo “normal” en aglutininas
febriles ha llegado a ser algo irrelevante, siendo mejor examinar un incremento
en el titulo después de un estudio inicial.
Un titulo O (somático) significante y
sospechoso para S. typhi es 1:160
pero un aumento del titulo en una repetición se considera más importante.
La presencia de antígenos comunes entre Brucella suis, Proteus, Salmonella y Vibrio
cholerae, darán reacciones cruzadas.
Brucella.- Casi todos los enfermos de
brucelosis aguda mostrarán un título de aglutininas de 1:160 o mayor en el
transcurso de 3 semanas después de la infección; los títulos pueden persistir
en cifras bajas durante meses o años, especialmente en los enfermos con
infección crónica, hay un problema de reacción cruzada serológica, con Francisella tularensis, vibrio cholerae
y ciertas cepas de Yersinia
enterocolitica.
Proteus OX-19.- El menor titulo que puede
considerarse significativo es 1:160 (dilución final), un aumento del titulo
debe ser por lo menos cuádruple para considerarse importante. Los títulos
máximos se encuentran generalmente durante la tercera semana después de la
iniciación de la enfermedad.
La fiebre Q y la
Rickettsiasis pustulosa no dan una prueba positiva del
Weil-Félix.
Las infecciones por Proteus y
la fiebre recurrente causada por espiroquetas del genero Borrellia también causan aumento de las aglutininas de Weil Félix.
138
RECOMENDACIONES
1.- No congelar
ninguno de los reactivos.
2.- Evitar utilizar
los reactivos fríos.
3.- La mayoría de
los sueros considerados como normales pueden mostrar títulos de 1:20, 1:40 y
ocasionalmente 1:80.
4.- La presencia de
títulos bajos puede ser debida a vacunaciones, a infecciones pasadas o
subclínicas.
5.- La mejor
indicación de un proceso activo lo marcan dos titulaciones sucesivas con una
diferencia importante entre el primero y segundo titulo, lo que nos indicaría
infección activa, aunque también se observa esto en los convalecientes.
6. Es conveniente
estudiar varias muestras de sangre del enfermo con diferencia de 5-7 días en
los casos dudosos.
Caducidad y
conservación.- Equipo completo.
La fecha de
caducidad para cada equipo se encuentra impresa en la etiqueta exterior, la
temperatura recomendada para conservarse es entre + 2° a + 8°C .
Frascos
individuales, la fecha de caducidad se encuentra impresa en la etiqueta y
pueden conservarse entre +2 y 8°C .
Control de
calidad.- Es recomendable el uso de los controles,
tanto positivo como negativo para asegurar la validez de los resultados dados.
CUESTIONARIO
1.- ¿Cuales son los antígenos identificables del
género Salmonella ?
2.- ¿Cuales son
los antígenos identificables del género Brucella ?
3.- ¿Cuales son
los antígenos identificables del género Proteus ?
4.- Explique el
fundamento para utilizar antígenos del género Proteus, para el
diagnóstico
de las enfermedades producidas por el género Rickettsia ?
5.- Describa la
técnica para la toma de la muestra de sangre.
6.- Describa la
técnica para obtener el suero.
7.- Describa la
técnica de aglutinación en placas.
8.- Describa la
técnica de aglutinación en tubos.
9.- Describa la
técnica para la interpretación de resultados.
10.- Explique el
fundamento de la aglutinación.
139
Práctica No. 11
PALUDISMO
Objetivos
1.- El alumno conocerá la morfología de las especies del género Plasmodium.
2.- El alumno conocerá el ciclo vital de las especies del género Plasmodium.
3.- El alumno conocerá la técnica de frotis para extendidos gruesos.
4.- El alumno conocerá la técnica de frotis para extendidos delgados.
5.- El alumno conocerá la técnica de tinción con coloración de Giemsa.
140
Introducción
Existen algunos parásitos eucarióticos que
afectan ya sea de manera transitoria o permanente la sangre y los tejidos del
cuerpo humano, provocando en los individuos portadores, diferentes cuadros que
pueden ser desde un estado asintomático el cual
no puede considerarse como un estado de completo bienestar físico, hasta
un cuadro clínico tan severo que ponga en riesgo la vida.
Los microorganismos de importancia médica
que pertenecen al reino protista, se encuentran clasificados en siete Phylos: Sarcomastigophora, Apicomplexa,
Microsporida, Ciliosphora, Mixospora,
Labyrinthomorpha y Ascetospora.
El phylum
Apicomplexa agrupa a dos subclases: Gregarinia
y Coccidia. La subclase Coccidia incluye a un solo Orden, Eucocidia que a su vez agrupa a tres
subórdenes de los cuales forma parte el Suborden Haemosporina. Los
microorganismos de la clase Sporozoea de este suborden llevan a cabo un complejo
ciclo de vida con fases reproductivas sexuales y asexuales alternadas, que
suelen afectar a dos diferentes huéspedes; artrópodos y vertebrados, incluyendo
al hombre.
En
la clase Sporozoea se encuentran
agrupados esporozoarios sanguíneos que incluyen al género Plasmodium.
El paludismo es una enfermedad causada por
parásitos de la sangre, del género Plasmodium
de gran prevalencia en los países en desarrollo, con 150 a 200 millones de casos que causan más de un
millón de muertes al año. Cada año se
diagnostican de 300 a 400 casos en
Norteamérica que son informados a los Centers for Disease Control (CDC) siendo
menos común en países industrializados,
El paludismo se
transmite al ser humano por inoculación de los esporozoítos infecciosos a
través de una gama de mosquitos, se conocen unas 60 especies de mosquito anópheles capaces de transmitir el
paludismo. Esta enfermedad también puede ser transmitida por transfusión de
sangre o productos sanguíneos infectados, incluyendo material no esterilizado
así como el uso de las mismas jeringas entre drogadictos. Otro mecanismo de
transmisión es el congénito.
El
paludismo es causado por cuatro especies de protozoarios del género Plasmodium: Plasmodium falciparum,
Plasmodium vivax, Plasmodium malarie y
Plasmodium ovale.
141
Las
infecciones causadas por Plasmodium
falciparum son mas fulminantes que las producidas por otros Plasmodios y
pueden provocar estado de coma e insuficiencia renal en dos a tres días. Además
las infecciones por Plasmodium falciparum
son a menudo resistentes a la cloroquina. Por lo que el laboratorio debe
proveer un diagnóstico rápido de las especies para elegir agentes antipalúdicos
adecuados y anticipar a las probables complicaciones.
Existen
diferencias entre las especies de Plasmodios en cuanto a la morfología de las
diferentes fases de su desarrollo y los tiempos de cada una de las secuencias o
estadios, algunas de estas diferencias son de gran importancia para la
identificación de las especies.
Ciclo vital
El vector y huésped definitivo para los
Plasmodios es la hembra del mosquito anópheles,
solo la hembra se alimenta de sangre. Existen dos fases en el ciclo vital de
los Plasmodios, la fase sexual y la fase asexual.
El ciclo sexual ocurre en los mosquitos y
recibe el nombre de “esporogonia”, debido a que da origen a esporozoitos. El
ciclo asexual se lleva a cabo en el hombre (huésped intermediario) y recibe el
nombre de “esquizogonia” debido a que origina esquizontes.
El ciclo vital en el hombre comienza con la
introducción de los esporozoitos a la sangre desde la saliva del mosquito al
picar. En el transcurso de 30 minutos, los esporozoitos viajan desde la lesión
inicial por el torrente sanguíneo hasta
el hígado, donde infectan a los hepatocitos. En esta fase
"exoeritrocitaria" el esporozoito multiplica su material
citoplasmático, adoptando una nueva morfología llamada esquizogonia primaria
exoeritrocítica, después de una demora de 8
a 25 días, según la especie del Plasmodium,
el parásito madura dando origen a un esquizonte hepático "esquizonte
criptozoico" con un tamaño entre 45
a 60 micras el cual se multiplica dando origen aproximadamente entre
10,000 a
40,000 merozoitos (según la especie) con un tamaño aproximado de 1 a 2 milimicras que poseen una membrana
trilaminar. A la membrana externa del
parásito, se encuentra adherida una especie de glicocálix o cubierta, que es
responsable de la fijación a los eritrocitos.
Plasmodium vivax y Plasmodium ovale producen una forma de
merozoito latente (hipnozoito) en el hígado estas formas parasitaria son la
causa de las recaídas.
142
Los merozoitos abandonan las células
hepáticas e infectan a los eritrocitos "fase eritrocitaria". Penetran en los hematíes por endocitosis, se
adhieren por su polo anterior (anillo polar) con intervención directa de la
cubierta del parásito a la membrana de los eritrocitos.
Substancias secretadas por los micronemas y
roptrias del Plasmodium,
provocan una invaginación de la membrana del hematíe y se forma inicialmente una cavidad en forma
de receptáculo o copa, en la cual se moverá el merozoito y posteriormente
formará una vacuola parasitófora en la que quedará englobado.
Durante este proceso, la
cubierta del merozoito queda retenida en la superficie del hematíe y finalmente
es desprendida y dispersada en el plasma sanguíneo. Ya en el interior del
eritrocito, el merozoito se nutre de la hemoglobina y se transforma en un
cuerpo pequeño y redondo de forma anular (trofozoito maduro).
Posteriormente el núcleo de
parásito se divide en varios fragmentos, pero sin división del citoplasma
(esquizogonia eritrocitaria), para luego diferenciarse a esquizonte maduro,
dando origen de (6 a 32) merozoitos
dependiendo de cada especie, que rompen la membrana del eritrocito.
Algunos de estos merozoitos, así
como los restos citoplasmáticos del parásito, son fagocitados por los
macrófagos y células endoteliales libres de los vasos sanguíneos. Los restantes
infectan a otros eritrocitos. Los esquizontes eritrocitarios maduros reciben
también el nombre de formaciones en "roseta", pues existe siempre una
masa citoplasmática residual con gránulos de pigmento, alrededor de la cual se
sitúan los merozoitos.
143
Este ciclo en los glóbulos rojos
se repite a intervalos regulares típicos para cada especie. La liberación
periódica de merozoitos causa los
síntomas recurrentes característicos de escalofríos, fiebre y diaforesis que
presentan los pacientes con paludismo.
Ciclo sexual
El ciclo sexual comienza en el
eritrocito humano cuando algunos merozoitos pasan a la forma de gametocitos
masculinos y otros a gametocitos femeninos. Los eritrocitos conteniendo a los
gametocitos son ingeridos por el mosquito hembra Anópheles y dentro de su
intestino se forma un macrogameto femenino y ocho microgametos masculinos
parecidos a espermatozoides.
Después de la fertilización, el
cigoto diploide se diferencia a oocineto móvil, que horada la pared intestinal
del insecto formando una madriguera en donde crece el oocineto a oocisto
enquistado, dentro del cual se producen numerosos esporozoitos haploides. Los
esporozoitos se liberan y emigran a las glándulas salivales del insecto, listos
para completar su ciclo cuando el mosquito pica a un individuo para ingerir su
sangre, introduciendo a los esporozoitos.
Plasmodium falciparum es la especie más importante,
la cual causa paludismo terciano maligno o subterciario, caracterizado por la
presencia de ciclos de fiebre que se presenta cada 36 a 48 horas. Plasmodium falciparum es la especie predominante en la mayoría de
los lugares tropicales y es la causa de entre el 80 y el 90 % de las infecciones de paludismo en aquellas
zonas.
144
La fase hepática de esta especie en el
hombre dura de 8 a 10 días y se cree que
solo es una población de parásitos que se desarrollan sincrónicamente en
cualquier momento. El esquizonte hepático totalmente desarrollado contiene unos
40,000 merozoitos, cantidad considerablemente mayor que en otras especies
(10,000 a 20,000 en promedio).
Los esquizontes eritrocitarios maduros de Plasmodium
falciparum contienen entre 8 y 32
merozoitos, con un promedio de 20 merozoitos mas que otras especies.
Los trofozoitos adultos tienen forma de
anillos pequeños de 1.5 micras es común
la frecuencia de varios trofozoitos
anillados en el interior de un eritrocito. El ciclo de infección en los
eritrocitos es más rápido en el caso de Plasmodium
falciparum (36 a 48 horas) en
comparación con el resto de las especies.
El aumento en el número de
parásitos en esta especie es por tanto mucho más rápido que en otras y esto,
junto con la capacidad del parásito de atacar eritrocitos de todas las edades,
provoca un rápido deterioro en la condición clínica del paciente no inmune, de
aquí el término de "terciano maligno".
Para el paludismo por Plasmodium falciparum, con frecuencia la
parasitemia es intensa, del 20 al 40 % de los eritrocitos pueden encontrarse
infectados, en comparación con tal vez un 5 % en infecciones por otras especies
y la repentina destrucción de este porcentaje de eritrocitos, tiene graves
consecuencias para el paciente.
145
Si bien se presentan esquizontes
eritrocititos en la infección por Plasmodium
falciparum, la gran mayoría de estas formas, en especial cuando la
parasitemia es relativamente baja, los parásitos se encuentran en los vasos
sanguíneos de los tejidos más profundos y no se ven en la sangre periférica.
Los esquizontes se observan solo en frotis de sangre de pacientes moribundos.
Plasmodium vivax causa paludismo terciano benigno, en el cual el ciclo de fiebre se
presenta cada 48 horas. Esta es la segunda especie más importante y se presenta
en una área geográfica mucho mayor en comparación con P. falciparum, desde
los trópicos y subtrópicos hasta algunas
zonas templadas del mundo. Ha producido infecciones endémicas en zonas del sur
de Gran Bretaña en el pasado reciente y en la década de 1920, se transmitió
hasta el mismo círculo Ártico.
Las fases eritrocitarias son morfológicamente distintas que las de Plasmodium falciparum, los esquizontes
hepáticos de P. vivax, contienen menos merozoitos.
Los
esquizontes maduros de Plasmodium vivax contienen de 14
a 24 merozoitos, los trofozoitos adultos tienen forma de
anillos grandes y
delgados 2 a 3 micras de diámetro. Los
eritrocitos viejos se infectan de manera preferencial y el porcentaje de
células infectadas puede ser menor que en las infecciones por P. falciparum.
El paludismo vivax es por tanto
menos grave en el paciente no inmune de aquí el término de "paludismo
terciano benigno".
146
Las recaídas de parasitemia y
fiebre son frecuentes en la infección por Plasmodium
vivax, pruebas recientes sugieren que estas recaídas son causadas por la
presencia de dos o mas poblaciones de parásitos en las células hepáticas, una
de las cuales se desarrolla como típicos esquizontes hepáticos y otra los
llamados “hipnozoitos”, subsisten por algún tiempo como pequeños parásitos
mononucleados que inician su ciclo de desarrollo después de semanas meses o
años de la infección inicial, produciendo las llamadas recaídas.
El tratamiento de las
fases eritrocíticas no es adecuado y se requieren tratamientos
"eficaces" durante estos estadios. Es una diferencia con al paludismo
falciparum, en el cual los medicamentos eficaces contra los estadios
eritrocíticos por si solos permiten un tratamiento acertado.
Plasmodium ovale también produce ciclos de fiebre de 48 horas, por lo general es menos
común que vivax en la mayoría de las zonas endémicas en las que ambos se
presentan, con excepción en África occidental en donde ovale es más común. Los esquizontes eritrocitarios maduros
en roseta de Plasmodium ovale contienen de 6 a 12 merozoitos grandes. Los
Trofozoitos maduros tienen forma de anillos grandes ocupan un tercio del
eritrocito con aproximadamente 2.5
micras de diámetro por lo general un granulo de cromatina, en forma de anillo grueso
Plasmodium malarie produce un ciclo febril de 72 horas (paludismo cuartano),
normalmente se localiza en zonas tropicales, y subtropicales, tiene mucha menor prevalencia que P. Falciparum y P. vivax. Los esquizontes hepáticos y eritrocíticos producen mucho
menos merozoitos que las otras especies, por lo que la parasitemia suele ser
baja, del orden de una célula infectada por cada 100 a 200 eritrocitos.
147
Ciertas anormalidades genéticas que afectan
a los eritrocitos, influyen en la susceptibilidad al paludismo. La deficiencia
de glucosa-6-fosfato deshidrogenasa de personas con genotipo
"homocigotos" se relaciona con mayor resistencia de los eritrocitos a
la invasión de los parásitos. También las personas con rasgos de células falciformes
(heterocigotos) se protegen contra el paludismo debido a que sus eritrocitos
tienen escasa actividad de ATPasa que no produce suficiente energía para
respaldar la multiplicación del parásito, sin embargo estos pacientes rara vez
viven lo suficiente para obtener algún beneficio de este hecho.
Manifestaciones clínicas
Periodo de incubación.- El
tiempo que existe entre la infección y la aparición de los signos y síntomas
clásicos, oscila entre los 9 a 40 días y
varía en razón de la especie, siendo mas corto en infecciones por Plasmodium
falciparum y más largo para P.
malarie y determinadas cepas de P. vivax, aisladas en el norte de
Europa y Rusia, para las que se ha propuesto el nombre de P. vivax ibernans.
Periodo Prepatente.- Tiempo
transcurrido entre la infección (picadura del mosquito) y el primer hallazgo
del parásito en la sangre, para P.
malarie es de 3 a 4 días, para P. vivax y falciparum entre 11 a 15
días y para P. ovale 14 a 16 días.
Acceso o paroxismo palúdico.-
Puede ir precedido de un periodo prodrómico con dolor torácico y abdominal,
artralgias, náuseas, vómito e incluso fiebre, aunque sin carácter de
perioricidad. El primer acceso palúdico señala el final del periodo de
incubación y consta de tres etapas o fases bien diferenciadas:
1.- Fase fría o de escalofrío violento.
Los síntomas de esta fase reflejan la existencia de una
descarga simpática con vaso constricción
periférica. Se caracteriza por escalofríos, cefalea frontal, mialgias, pulso
rápido y débil, piel pálida, fría y seca con aspecto de "carne de
gallina" (cutis anserina), cianosis labial y en dedos, náuseas, vómito y
en menores pueden presentarse convulsiones, el tiempo de duración es de 1 a 2 horas.
2.- Fase de calor o periodo febril.
La temperatura corporal sube hasta 41° C. Se produce una
intensa vasodilatación, la piel esta ardiente y seca y la cara congestionada.
Hay cefalea intensa, taquicardia, taquipnea, dolor abdominal, náuseas, vómitos
y en ocasiones tos y delirio. Es frecuente la presencia de hipotensión
ortostática como consecuencia de la vasodilatación. La duración de esta etapa
dura de 2 a
6 horas.
148
3.- Fase de sudoración.
La temperatura corporal desciende hasta límites normales y
el enfermo presenta una intensa diaforesis y poliuria. Este periodo tiene una
duración de 2 a
4 horas.
A este primer acceso siguen
otros durante un periodo de tiempo no
menor a 2 semanas. Entre un acceso y otro, el paciente esta asintomático,
aunque en las infecciones por P.
falciparum la fiebre puede persistir. Los accesos se presentan a intervalos
regulares de tiempo; Cada 48 horas en los casos de P. vivax y P. ovale
(terciano benigno); así como para P. Falciparum (terciano maligno). De
72 horas para P. malarie (cuartano).
No obstante, a veces no existe
perioricidad, sobre todo al principio del cuadro clínico. Además, la mayor
parte de las infecciones por P.
falciparum no siguen el ritmo de terciana, los accesos febriles pueden
aparecer diariamente e incluso es posible que exista fiebre continua. Sin
tratamiento la enfermedad pasa a mostrar un curso clínico y suele curar al
desarrollarse la inmunidad especifica varios años mas tarde, 5 años en casos de
paludismo por P. vivax y P. ovale, de 20 a
30 años para casos de P. malarie.
El pronóstico del paludismo por
P. falciparum es más sombrío, dado que, aunque la curación espontánea pueda
presentarse al cabo de un año, lo normal es que el enfermo fallezca antes de
ese tiempo.
Inmunidad
La respuesta inmunitaria se produce fundamentalmente frente a las
formas asexuadas eritrocíticas. Los gametos y formas exoeritrocíticas no
producen la formación de anticuerpos,
aunque estas últimas sean capaces de reaccionar con ellos. Los esporozoitos son
inmunógenos experimentalmente, pero en infecciones humanas se desconoce este
hecho. La mayor parte de las inmunoglobulinas sintetizadas (Ig M, Ig G e Ig A)
en el curso de la infección palúdica, como consecuencia del estímulo de los
parásitos intraeritrocitarios, carecen de actividad protectora.
El hecho principal en la
patogenia del paludismo es la lisis de los hematíes parasitados y no
parasitados, pues produce la descarga en
el torrente circulatorio de parásitos, pigmentos, restos celulares y material
tóxico no identificado, que producen fiebre, anemia, hipoxia tisular, estímulo
para la fagocitosis, pigmentación cutánea y de otros órganos, así como una
serie de fenómenos inmunopatológicos.
149
Examen físico
No existen adenopatías, pero si
hepatomegalia. La palpación esplénica si se realiza de forma violenta es
peligrosa y puede ser posible la ruptura visceral. La piel adquiere un tinte
ocre y terroso y son frecuentes la urticaria "rash" petequial e
incluso las hemorragias.
Datos de laboratorio
Hay anemia hemolítica normocrómica y normocítica, al menos al
principio, leucopenia con granulocitopenia y linfopenia (relativa o absoluta) y
trombocitopenia con monocitosis. En casos de nefropatía existe proteinuria. Es
frecuente el hallazgo de pigmento en el interior de los monocitos.
Diagnóstico de laboratorio
El diagnostico
definitivo del paludismo esta basado en la demostración de los parásitos en la
sangre. Se emplean dos tipos de preparaciones de sangre. La gota gruesa permite
el examen de una mayor cantidad de sangre y se emplea como procedimiento de
elección. Los frotis de sangre se preparan por lo general cuando el paciente ingresa al hospital, después deben
tomarse muestras cada 6 a 8 horas, por
lo menos durante tres días consecutivos hasta identificar las formas
parasitarias.
Antes de considerar un preparado
como negativo, deben observarse 200 campos microscópicos. Si es posible los
extendidos deben ser preparados con sangre tomada de la punta del dedo o del
lóbulo de la oreja; la sangre debe fluir libremente.
Si no es posible tener contacto
con el paciente y los extendidos son malos, se debe solicitar un tubo con
sangre recién extraída (se recomienda EDTA como anticoagulante) y preparar los
extendidos inmediatamente al recibir la muestra.
Para preparar un extendido
grueso, colocar 2 a 3 gotas pequeñas de
sangre, sobre una área de unos dos centímetros de diámetro. Continuar con la
agitación durante 30 segundos, para evitar la formación de cordones de fibrina
que podrían impedir la visualización de los parásitos después de la tinción. Si
el extendido es demasiado grueso o el portaobjetos no ha sido bien desgrasado, la sangre será arrastrada durante
el proceso de coloración. Dejar secar a temperatura ambiente en una área libre de polvo.
150
No se debe calentar nunca un
extendido grueso ya que el calor fijará la sangre y los eritrocitos
permanecerán intactos durante la tinción, el resultado será la retención del
colorante con la consiguiente dificultad para identificar los parásitos que
pudieran estar presentes.
El extendido delgado se usa
principalmente para la identificación de la especie del parásito, aunque el
número de microorganismos por campo es mucho menor que en la gota gruesa.
Como regla general los
extendidos deben ser teñidos lo más pronto posible, ya que una demora
prolongada, provoca retención del colorante.
Las coloraciones
empleadas, son de dos tipos. Uno incluye el fijador en combinación con el
colorante de modo que la fijación y la tinción ocurren simultáneamente, la
coloración de Wright es un ejemplo. La tinción de Giemsa representa el otro
tipo en el cual el fijador y el colorante se aplican en forma separada, en
consecuencia el extendido delgado debe ser fijado antes de la coloración.
Coloracion de Giemsa
El colorante de Giemsa se encuentra en el comercio como solución madre
concentrada o como polvo para quienes prefieren prepararla por si mismos.
Cualquier infección parasitaria
presuntiva o los diagnósticos de fiebre de etiología a determinar exigen
un examen manual de extendido de sangre.
Reactivos
1.- Solución madre de Giemsa:
Colorante de Giemsa en polvo
certificado..........................................600 mg.
Metanol absoluto, certificado, neutro y
libre de acetona. ................... 50 ml.
Glicerina neutra,
certificada..................................................................
50 ml.
·
Moler
proporciones muy pequeñas de colorante y de glicerina en un mortero y recoger
las mezclas en un frasco de 500 o 1000 ml hasta completar la cantidad
necesaria.
·
Tapar
el frasco con un tapón de algodón, cubrir con un papel grueso y colocar en un
baño de agua entre 55 60° C. durante dos
horas, cuidando que el agua alcance el nivel del colorante.
151
·
Agitar suavemente cada media hora.
·
Dejar
enfriar y agregar el alcohol.
·
Usar
una proporción del alcohol medido para lavar el mortero y agregarlo al frasco.
·
Conservar
en una botella color caramelo.
·
Dejar
reposar 2 a
3 semanas, filtrar antes de usar.
2.- Solución madre de tritón X-100 al 10 %:
Tritón X- 100...................................... 100 mg.
Agua destilada................................... 100 ml.
3.- Solución madre para el buffer:
a.- Solución de fosfato disódico:
Fosfato disódico
anhidro........................ 9.5
g .
Agua
destilada......................................1000 ml.
b.- Solución de fosfato monosódico:
Fosfato
monosódico..............................
9.2 g .
Agua
destilada......................................1000 ml.
4.- Agua con PH regulado: PH entre 7.0 a 7.2,
controlar con el medidor del PH.
Solución de fosfato
disódico........................61 ml.
Solución de fosfato
monosódico..................39 ml
Agua
destilada…........................................900 ml.
Usar para extendidos delgados o combinación de extendidos delgados y
gruesos.
5.- Solución de tritón en agua con PH regulado:
a.- Tritón al 0.01 % -agua regulada-
Solución madre de tritón
X-100 al 10 %.............1 ml.
Agua con PH
regulado................................. 1000 ml.
Para extendidos gruesos usar:
b.- Tritón al 0.1 % -agua regulada
Solución madre de Tritón
X-100 al 10 %.......... 10 ml.
Agua con PH
regulado……............................ 1000 ml.
152
Procedimiento para extendidos
delgados
1.- Fijar los extendidos de sangre en metanol absoluto (libre de acetona)
durante 30 segundos.
2.- Dejar secar al aire.
3.- Sumergir los portaobjetos en una solución formada por una parte de
solución madre de Giemsa (comercial o preparada a partir del colorante en
polvo) en 10 a 50 partes de tritón agua
regulada- (PH 7.0 a 7.2).
4.- Teñir durante 10 a 60
minutos (ver nota mas adelante). La
solución de trabajo debe ser preparada diariamente a partir de la solución
madre.
5.- Sumergir los preparados brevemente en la solución de tritón -agua regulada-.
6.- Escurrir colocando los portaobjetos en posición vertical y dejar
secar al aire libre.
Nota.- Una buena regla general para recordar las diluciones y los
tiempos de tinción es que si la solución colorante esta en dilución de 1:20, se
debe teñir durante 20 minutos, si está a 1:30, durante 30 minutos, etc. Sin
embargo deben ensayarse una serie de diluciones y tiempos de tinción para
determinar la mejor relación dilución y
tiempo, para cada lote de solución colorante.
Procedimiento para extendidos
gruesos.- El procedimiento a seguir para la coloración de extendidos gruesos, es
el mismo que para extendidos delgados, omitiendo los dos primeros pasos.
Cuestionario
1.- Describa el
ciclo vital de los Plasmodios.
2.- Describa las
características morfológicas de los esquizontes maduros de Plasmodium
falciparum.
3.- Describa las
características morfológicas de los trofozoítos de Plasmodium falciparum.
4.- Mencione dos
diferencias morfológicas entre los esquizontes maduros de Plasmodium
falciparum y Plasmodium vivax.
5.- ¿ Cuales son
las especies de Plasmodios que producen Paludismo terciano benigno ?.
6.- ¿ Cual es la
especie de Plasmodium que produce Paludismo terciano maligno ?.
7.- ¿
Cual es la especie de Plasmodium que produce Paludismo cuartano ?.
8.- Mencione el
sitio y la técnica para la obtención de sangre para los frotis.
9.- Mencione la
técnica para hacer el frotis de un extendido delgado.
10.- Describa la técnica de tinción con colorante de Giemsa
en frotis delgados,
153
Práctica No. 12
TRIPANOSOMIASIS
Objetivos.
1.- El alumno conocerá las características morfológicas de las especies
del género Tripanosoma.
2.- El alumno conocerá el ciclo biológico de las especies del género Tripanosoma.
3.- El alumno identificará por microscopia la morfología de las especies
del género Tripanosoma.
4.- El alumno conocerá los medios de cultivo útiles para el aislamiento
de las especies del género Tripanosoma.
5.- El alumno conocerá el xenodiagnóstico como método diagnóstico.
154
Tripanosomiasis
A una
úlcera inicial que aparece posterior a la picadura de la mosca Tsé Tsé seguirán fiebre persistente hasta por una
semana, adenopatía generalizada, edema, signo de Romaña (T. Cruzy) como signos
característicos de la enfermedad. La
anemia y la infiltración encefálica producen astenia y alteraciones al estado de consciencia como
letargo y estupor de ahí su nombre “la enfermedad del sueño”, la insuficiencia
renal, la miocarditis y el coma ocasionan la muerte.
Clasificación
Los Tripanosomas pertenecen al phylum
Sarcomastigophora.- Los miembros de este phylum se caracterizan por poseer
un único núcleo, cuando existe
sexualidad es por singamia , la movilidad es conferida por flagelos, pseudópodos,
o por ambos. El Phylum sarcomastigospora incluye a su vez tres subphylos; Mastigophora
Opalinata y Sarcodina. El subphylum Mastigophora agrupa organismos
cuyas formas adultas o trofozoitos poseen uno o más flagelos, su reproducción
asexual se produce por fisión binaria, su reproducción sexual no es bien
conocida.
El subphylum Mastigophora incluye a su
vez dos clases Phytomastigophora y Zoomastigophora, este último
subphylum agrupa a cinco órdenes, uno de ellos, Kinetoplástida incluye a
un suborden, Tripanosomatina cuyos miembros se caracterizan por poseer
un flagelo libre o fijo al cuerpo provisto de una membrana ondulante.
El género tripanosoma del Orden
Kinetoplástida incluye a tres especies patógenas para el hombre Tripanosoma
gambiense, Tripanosoma rhodesiense (Africa central) y Tripanosoma
cruzi (Centro y Sudamérica). El género Trypanosoma se caracteriza por utilizar a dos tipos de
huéspedes para completar su ciclo de vida, uno vertebrado y otro invertebrado.
Los tripanosomas que causan en
Africa la enfermedad del sueño T. Gambiense y T. rhodesiense, son transmitidos por vector, existen por lo
menos 22 especies de moscas Tsé Tsé hematófagas del género Glossina, la mayoría obtienen su alimento de animales
salvajes y del hombre propagando la parasitosis.
155
Tripanosoma gambiense produce
la enfermedad del sueño en el centro y occidente de Africa, Senegal, Angola,
Zaire y el Congo. La mosca Tsé Tsé (Glossina morsitans) hematófaga
infectada, transmite la enfermedad
cuando pica al humano para chupar la sangre, depositando las formas
metacíclicas del Tripanosoma que invade los tejidos hemático-linfáticos, bazo,
hígado, sangre, riñón, encéfalo multiplicándose y produciendo una parasitemia .
La
invasión de los tejidos produce un reacción inflamatoria intensa con
infiltración de monocitos, macrófagos, linfocitos, células plasmáticas con
infiltración perivascular y proliferación degenerativa de células endoteliales.
El líquido céfalorraquídeo de aspecto turbio y con abundantes parásiros aumenta
su volumen ocasionando edema cerebral.
Cefalea intensa, somnolencia, letargo, crisis convulsivas, ilusiones,
alucinaciones, trastornos del equilibrio y la falta de coordinación de
movimientos voluntarios son signos que se presentan antes del coma y son de mal
pronóstico.
Tripanosoma rhodesiense es endémico en
Tanzania y Uganda, es el agente causal de la enfermedad del sueño rápidamente
mortal, no es raro que el enfermo muera durante el periodo de incubación, es
decir, antes de las manifestaciones neurológicas.
Trypanosoma brucei es una especie incapaz de
producir la enfermedad en el hombre en condiciones naturales, sin embargo la
enfermedad se hace evidente en inmunocomprometidos. T. Brucei afecta al
ganado salvaje como antílopes, en el ganado vacuno la enfermedad es mortal de
ahí el nombre de Nagana.
Tripanosomiasis Americana, Enfermedad de
Chagas o Romaña Mazza es causada por Tripanosoma cruzi, protozoario
intracelular del Sistema Retículo Endotelial e invade particularmente
endocardio, tubo digestivo y Sistema Nervioso central. Las lesiones se
caracterizan por destrucción de células grasas que dan origen a lipogranulomas.
156
La
infección puede adquirirse a través de transfusiones sanguíneas, transplante de
órganos o por vía transplacentaria de madre a feto. La infección se adquiere también por la
ingesta de alimentos contaminados. Los mamíferos que actúan como reservorio
frecuentemente adquieren la enfermedad al comer chinches infectadas.
Ciclo biológico
Estas chinches se infectan al
picar y chupar la sangre a un animal infectado, ingiriendo así al parásito (en
su estadio de tripanosomas). Dentro de la chinche y a lo largo de su tracto
digestivo, el parásito sufre una serie de transformaciones antes de ser
expulsado en las heces.
En el estómago del insecto, los tripanosomas
se redondean formando amastigotes, a mitad de su intestino se transforman en
epimastigotes que se replican mediante fisión binaria y finalmente,
aproximadamente 2 semanas después, llegan al recto, donde se convierten en
tripanosomas metacíclicos listos para ser expulsados.
La infección en los mamíferos se inicia cuando un insecto
infectado defeca mientras se alimenta, liberando tripanosomas metacíclicos en
sus heces. Los tripanosomas, incapaces de atravesar la piel intacta, entran al
organismo a través de excoriaciones de la piel (sitio de la mordedura o picadura),
invadiendo inmediatamente a histiocitos o monocitos, ya dentro de estas
células, los tripomastigotes pierden su flagelo y se redondean adquiriendo una
nueva morfología parasitaria,
amastigotes, que se multiplican intracelularmente por fisión binaria.
Los amastigotes maduran intracelularmente y se
transforman en tripomastigotes, los cuales son liberados a los espacios
intersticiales y al torrente sanguíneo, rompiendo la célula. Los
tripomastigotes tienen la habilidad de invadir otras células, dónde se
transforman de nuevo en amastigotes, repitiéndose indefinidamente el ciclo de
infección. El ciclo de vida se cierra cuando un triatómino se alimenta de un
animal con tripanosomas en la
circulación periférica.
T. cruzi es un protozoo flagelado de 7 a 20 micras, cuyas
características morfológicas varían según
la fase biológica en que se encuentre. La forma de tripanosoma se
observa sólo en la sangre circulante,
sin embargo no se multiplica en ella, a diferencia de los tripanosomas
africanos.
Los
parásitos infectan a todo tipo de
células nucleadas, con marcada preferencia por células musculares
cardiacas, macrófagos, neuronas y tejido glial.
157
La
destrucción de las células parasitadas da inicio a una intensa respuesta
inflamatoria ocasionando miocarditis aguda, meningoencefalitis con destrucción
de ganglios en el tracto gastrointestinal.
La respuesta inmune celular y humoral hace que descienda el número de parásitos en sangre y en los
tejidos a niveles tan bajos, que en ocasiones no es posible detectar a los parásitos
con los métodos usuales de diagnóstico como en las tinciones con Giemsa en las
muestras de sangre periférica.
Algunas
personas pueden ser portadores asintomáticos y el daño tisular se limita
a pequeños focos de inflamación con
fibrosis y pérdida limitada de tejido
ganglionar. En los casos de cardiopatía Chagásica severa, hay
destrucción importante de las células musculares cardiacas y del tejido de
conducción con fibrosis difusa e infiltrado inflamatorio.
Cuadro clínico
El periodo de Incubación es de 1 a 2 semanas (4-12 días) y el cuadro clínico
se divide en fases: Aguda, latente y crónica.
Fase aguda
·
Más
frecuente en niños, dura de 2 a
4 meses, se presenta el signo de (Romaña-Mazza) que consiste en un edema
bipalpebral, unilateral, con adenopatías, con tono púrpura, conjuntivitis.
·
Chagoma
de inoculación.- Nódulo linfocutáneo, durante la parasitosis y diseminación.
·
Fiebre,
cefalea, anorexia, malestar general, vómito, diarrea, mialgias, artralgias,
anasarca.
·
Miocarditis
aguda.- Taquicardia, insuficiencia biventricualr, acompañada por derrame
pericárdico que evoluciona a insuficiencia cardiaca congestiva, de instalación
súbita y curso violento.
·
Meningoencefalitis,
se limita a los niños y casi siempre es mortal, el pronóstico en la fase aguda
generalmente es bueno, remite espontáneamente, la globulina aumenta y la
albúmina disminuye.
158
Fase latente o
indeterminada
A esta fase también se lo conoce como subclínica o infección chagásica.
·
Desaparece
la sintomatología.
·
Serología
(+); estudios de Electrocardiograma y Rayos X sugestivos de endocarditis o bien
normales.
Fase crónica
·
Inicio
de síntomas de enfermedad progresiva, taquicardia, palpitaciones, arritmias
ventriculares, dolor precordial leve sin síncope, fibrilación, bloqueo A-V total
o parcial, bloqueo completo de la rama derecha del haz de his, etc.
·
Megacolon:
flatulencia, estreñimiento, asas dilatadas,
colecistitis.
·
Megaesófago:
disfagia, odinofagia, pirosis, eructos, dolor torácico, sialorrea.
·
Sistema
Nervioso Central, se ha atribuido la pérdida de los reflejos tendinosos
profundos.
Tripanosomiasis congénita: Puede causar
aborto o infección congénita, daño neurológico progresivo, hemorragias cutáneas
y alteraciones del EKG (mortalidad del 50%).
Morfología e
identificación
Tripanosoma gambiense se encuentra principalmente en
sangre humana en forma adulta o
tripomastigote y mide entre 14
a 33 micras de largo por 1.5 a 3.5 micras de ancho. En
las preparaciones teñidas con el método de Giemsa, el citoplasma se tiñe de
color azul pálido, contiene vacuolas y gránulos de volutina (material
glucoproteico) que se tiñen azul oscuro.
El núcleo de posición central se tiñe de
color rojo púrpura, en preparaciones fijadas con hematoxilina, se puede
distinguir la membrana nuclear y el cariosoma central.
El Kinetoplasto situado en el extremo
posterior al núcleo formado por un corpúsculo parabasal y el blefaroblasto
aparecen como dos pequeñas manchas de color azul rojizo.
159
La membrana ondulante se tiñe de azul pálido
esta se origina en el blefaroblasto pasa por arriba y adelante del núcleo y
termina en el borde anterior del citoplasma, desde donde se extiende hacia el
extremo libre formando el flagelo.
Los tripomastigotes de Tripanosoma
rhodesiense miden entre 15 y 30 micras de largo por 1.5 a 3.5 micras de ancho,
sin embargo, morfológicamente estas dos especies son indistinguibles entre sí.
La morfología de Tripanosoma cruzi se
puede estudiar en preparaciones fijas con técnica de Giemsa, en el huésped
mamífero se encuentra en sangre periférica principalmente en dos etapas de su ciclo vital, tripomastigoto
y amastigoto.
Los tripomastigotes de T. Cruzi
adoptan la forma de la letra C, miden de 7 a 20 micras de largo, su citoplasma se tiñe
de azul pálido, el núcleo central y el Kinetoplasto posterior se tiñen de color
rojizo púrpura. La raíz del flagelo nace en blefaroplasto y se extiende por el
borde de la membrana ondulante que alcanza el extremo anterior y sale como
flagelo libre en el extremo anterior.
Durante el ciclo vital
de estos parásitos es posible encontrar diferentes formas parasitarias que
atendiendo al lugar de origen del flagelo es posible identificar los siguientes
tipos morfológicos, empleando la nonmenclatura de Guayasse (1966) y completada
por Brack (1968).
Amastigote.-
Cuerpo redondeado con cinetoplasto, gránulo basal y el flagelo reducido a una
pequeña porción.
160
Promastigote (leptomona).- Cuerpo alargado núcleo central y flagelo
anterior.
Epimastigote (critidia).- Gránulo
basal situado arriba del núcleo.
Tripomastigote metacíclico.- Parásito intracelular en diferente tejido,
corazón, músculo esquelético, sistema nervioso central, tubo digestivo, tejido
glandular.
El
diagnóstico se basa en la demostración de los parásitos en sangre mediante
microscopía con tinción de Giemsa. El aislamiento de los parásitos en los medios de cultivo NNN, Nagashi-Nakamura, Kenser,
Warren se utilizan cuando el examen microscópico resulta
negativo.
Un
método eficaz para aislar T. cruzi es el xenodiagnóstico en este método
se utilizan chinches sanas, triatóminos de laboratorio que se alimentan de la
sangre del paciente, posteriormente, 4 semanas después las heces de la chinche
y su contenido intestinal es examinado en búsqueda de los parásitos.
El diagnóstico puede establecerse también demostrando anticuerpos
específicos de tipo IgM o que los títulos de anticuerpos específicos IgG se
cuadripliquen.
Cuestionario.
1.- Describa el ciclo biológico
de las especies del género Tripanosoma.
2.- Describa las características morfológicas de amastigotes de las
especies del género Tripanosoma.
3.- Describa las características morfológicas de Trypomastigotes de las
especies del género Tripanosoma.
4.- Describa las características morfológicas de Trypomastigotes de T. Cruzi.
5.- ¿Qué
es el Xenodiagnóstico?
161
Práctica No. 13
HEMOCULTIVO
Objetivos.
1.- El alumno
conocerá la importancia del hemocultivo como método para el diagnóstico
etiológico y tratamiento de las septicemias y fiebres de origen desconocido.
2.- El alumno
conocerá a los microorganismos que se aíslan con mayor frecuencia en los
hemocultivos.
3.- El alumno aplicará
la técnica para la toma de la muestra para el hemocultivo.
4.- El alumno
aplicará la técnica para hacer un hemocultivo.
5.- El alumno
interpretará los resultados positivos o negativos de un hemocultivo.
162
Introducción
La
septicemia y el shock séptico son síndromes clínicos espectaculares que se
deben a la invasión aguda del torrente sanguíneo por ciertos microorganismos
y/o sus toxinas. Las manifestaciones ordinarias de la septicemia aguda son:
escalofrío, fiebre, taquicardia, taquipnea, alteraciones mentales y otros síntomas
generales.
Cuando aparece hipotensión y signos de riego
sanguíneo insuficiente a órganos y sistemas, el proceso se denomina shock
séptico.
La
insuficiencia circulatoria que acompaña al shock séptico, se caracteriza por
una resistencia vascular muy disminuida, descenso de la función contráctil del
miocardio, estancamiento y mala distribución de la sangre en la micro
circulación, aparecen lesiones celulares y tisulares difusas (coagulación
intravascular diseminada CID) y
finalmente el fracaso generalizado de los órganos lleva a la muerte.
Las
manifestaciones de septicemia, pueden verse en infecciones sistémicas graves,
ocasionadas por un gran número de microorganismos, sin embargo, el shock
séptico franco se debe a bacterias Gram negativas, (E. coli, Klebsiella, Proteus,
Pseudomonas) hasta en un 65% del total de los casos y un 30% se debe a
bacterias Gram positivas (Staphylococcus,
Streptococcus piogenes, S. viridans y S. pneumoniae principalmente).
Actualmente
se calcula que en Estados Unidos la incidencia de bacteriemia tan solo por
bacilos Gram negativos, se encuentra alrededor de 500,000 casos anuales.
Entre
los principales factores de riesgo que conducen a una septicemia se encuentran:
Diabetes mellitus, cirrosis hepática, alcoholismo, leucemia, cáncer,
quimioterapia citotóxica, fármacos inmunosupresores, técnicas quirúrgicas
(apendicectomía), colecistectomía, cesárea, aborto, etc.), infecciones de tubo
digestivo, aparato urinario, heridas y quemaduras infectadas.
A
pesar de un tratamiento con antimicrobianos adecuados muchos enfermos mueren de
shock séptico, la tasa de mortalidad por septicemia producida por bacilos Gram
negativos es del 25% del total de los
casos y el total de muertes producidas por bacilos Gram positivos es del 10%.
Dado
que la bacteriemia con frecuencia augura un padecimiento que pone en peligro la
vida, la detección oportuna del agente etiológico es esencial.
163
El
hemocultivo es el procedimiento sencillo más importante que se hace en el
laboratorio de microbiología para identificar a los géneros y especies
bacterianas causantes de septicemia,
este método es esencial en quien se sospeche de una endocarditis
infecciosa, aun en el caso de que el paciente no muestre indicios de un
padecimiento agudo o de gravedad. Además de su significado en el diagnóstico,
el aislamiento del agente infeccioso de la sangre constituye una ayuda
inapreciable en la determinación del tratamiento antimicrobiano. Por lo tanto,
en la bacteriemia deberán efectuarse todos los esfuerzos posibles para aislar
el microorganismo causal.
En
personas sanas, las muestras obtenidas de manera apropiada son estériles.
Aunque en ocasiones los microorganismos de la flora normal respiratoria y
gastrointestinal pasan a la sangre, son eliminados con rapidez por el sistema
retículo endotelial. Estos microorganismos transitorios rara vez interfieren en
la interpretación de resultados. Si el hemocultivo revela microorganismos, este
hecho es de sumo interés clínico siempre y cuando puedan excluirse los errores
técnicos.
La
contaminación de los hemocultivos con
flora cutánea normal se debe comúnmente
a errores durante la recolección, por consiguiente, se requiere una técnica
apropiada en este procedimiento.
Se
debe hacer uso de un equipo estéril y técnicas asépticas apropiadas. La piel
debe ser limpiada con tintura de yodo al 2% en círculos que se irán ensanchando
desde el sitio propuesto para la punción. El exceso de yodo se elimina con
alcohol a un 70%. Deben extraerse 20 mL de sangre, los cuales deben inocularse
en frascos estériles con medios para cultivo anaerobio y aerobio. Deben
incubarse a 37°C .
Varios
factores determinan si los hemocultivos producirán resultados positivos, por
ejemplo el volumen de sangre cultivada, su dilución en el medio de cultivo, el
uso de medios de cultivo aerobio y anaerobio y el tiempo de incubación.
Para
adultos por lo general se obtienen 20 mL de sangre, una mitad se coloca en un
frasco de hemocultivo para aerobios y la otra en uno para anaerobios,
comprendiendo ambos un solo hemocultivo. Sin embargo, es posible que se
requieran volúmenes diferentes para los numerosos sistemas de hemocultivo que
existen.
Un
sistema de hemocultivo de uso extenso usa botellas que contienen 5 ml de sangre
en vez de 10 ml. La mayor parte de los
medios usados, contienen 0.05% de polianetol sulfonato de sodio (SPS), que
inhibe la proliferación de neisserias, cocos anaerobios Gram negativos y Gardnerella vaginalis.
164
Si se
sospecha la presencia de cualquiera de estos microorganismos, deberán
utilizarse sistemas alternativos para hemocultivo que no contengan SPS.
Los
hemocultivos se incuban durante cinco a siete días a menos que sea indicado
específicamente por el médico que puede estar presente un patógeno de
crecimiento lento (por ejemplo, Brucella).
En
sistemas manuales los frascos para hemocultivo son examinados dos a tres veces
al día durante los primeros dos días y diariamente después durante una semana.
Los sistemas de hemocultivo automático usan una diversidad de métodos para
detectar cultivos positivos: detección de CO2 por espectroscopia infrarroja,
detección colorímetra de cambios de pH, detección fluorométrica de productos metabólicos y detección electrónica de cambios de presión. Estos métodos
automatizados permiten la vigilancia frecuente de los cultivos y la detección temprana de los
positivos en comparación con los métodos manuales. Muchos laboratorios
subcultivan regularmente cultivos de sangre para detectar organismos que no son visibles y que no han sido detectados
por el sistema automatizado.
El
número de muestras de sangre que deben extraerse y el periodo durante el cual deberá hacerse dependen en parte de la gravedad del padecimiento
clínico. En las infecciones hiperagudas, por ejemplo, septicemia
por Gram negativos con choque o
septicemia por estafilococos, es apropiado cultivar dos muestras de sangre
obtenida de sitios anatómicos distintos en un periodo de 10 minutos. En otras
infecciones bacteriémicas, por ejemplo, endocarditis, deberán obtenerse tres
muestras durante el lapso que va
desde algunas horas hasta 24 horas. Un
total de tres hemocultivos descubren la
bacteria infectante en más del 95 % de los pacientes bacteriémicos. Si los tres
cultivos iniciales son negativos y se
sospecha de un absceso oculto, fiebre de origen desconocido o alguna otra
infección obscura, deben cultivarse muestras adicionales antes de iniciar el
tratamiento con antimicrobianos.
Se
obtiene una proporción más elevada de resultados positivos cuando se toma la
muestra durante un acceso febril.
Se
dispone de frascos para hemocultivo que contienen resinas que absorben una gran
parte de los antimicrobianos así como factores antimicrobianos del huésped.
Las
indicaciones para el uso de frascos con resina son las siguientes:
1. Pacientes
sépticos que están recibiendo
terapéutica con antimicrobianos cuyos hemocultivos ya han dado
resultados negativos.
165
2. Pacientes
con datos clínicos de endocarditis y hemocultivos negativos y que esta recibiendo terapéutica con
antimicrobianos.
3. Pacientes
admitidos en el hospital con sepsis a los que se les ha administrado
antimicrobianos antes de la admisión.
Los
frascos que contienen resina no deberán usarse para seguir la eficacia del
tratamiento debido a que la resina puede absorber los antimicrobianos de la
muestra y permitir que el cultivo se
vuelva positivo a pesar de la eficacia clínica del tratamiento.
Es
necesario determinar el significado de
un hemocultivo positivo. Los siguientes criterios pueden ser útiles para
diferenciar las muestras “positivas verdaderas" de las contaminadas:
·
La proliferación del mismo microorganismo en
cultivos repetidos, obtenidos en diferentes momentos de sitios anatómicos
separados, es muy sugestiva de bacteriemia verdadera.
·
La proliferación de microorganismos diferentes
en frascos de cultivo distintos sugiere
contaminación, pero en ocasiones puede representar problemas clínicos como
fístulas enterovasculares.
·
La proliferación de la flora cutánea normal,
por ejemplo Staphylococcus epidermidis,
difteroides (corinebacterias y propionebacterias) o cocos anaerobios Gram
positivos, en solo uno de varios cultivos, sugiere contaminación. Su
proliferación en más de un cultivo o en muestras de un paciente con prótesis
vascular, incrementa la probabilidad de bacteriemia con significado clínico.
·
La proliferación de microorganismos como los Streptococcus viridans o los enterococcus es probable en los cultivos
de pacientes en quienes se sospeche de endocarditis y la de bacilos Gram negativos
como E. coli en los cultivos de
enfermos con septicemia por Gram
negativos; por tanto es lógico que el encontrar estos microorganismos esperados
tenga importancia etiología.
Casi todas las
especies han proliferado en los
hemocultivos en algún momento.
La
mayor parte de los hemocultivos han dado resultados positivos a partir de su fórmula, los medios enriquecidos
generalmente contienen infusión de cerebro y corazón adicionado de Agar, ácido
paraaminobenzoico o penicilinasa. Estos medios permiten el crecimiento de
bacterias tanto aerobias como anaerobias. El ácido paraaminobenzoico y la
penicilinasa anulan el efecto bacteriostático y bactericida de Sulfas y
penicilinas.
166
Los
siguientes microorganismos son los que se encuentran con mayor frecuencia en
los hemocultivos:
Staphylococcus, incluyendo Staphylococcus aureus.
Estreptococos viridans.
Enterococcus, incluyendo Enterococcus feacalis.
Bacterias
entéricas Gram negativas, incluyendo E.
coli, S. tiphy.
Brucellas.
Klebsiella pneumoniae.
Pseudomona aeruginosa.
Diplococcus pneumoniae.
H. influenzae.
Especies de Cándida.
Otras levaduras
y algunos otros hongos bifásicos, como Histoplasma capsulatum.
En la
mayor parte de los tipos de bacteriemias, no es útil el examen directo de
frotis sanguíneos.
Las
indicaciones para la obtención de
cultivos de sangre son múltiples, pero básicamente lo son; un cambio súbito de
la frecuencia del pulso y la temperatura, acompañado o no de escalofríos,
postración e hipotensión; una historia
de fiebre leve, intermitente y persistente, asociada con un soplo cardiaco y generalmente cualquier
sospecha de sepsis.
La
bacteriemia suele ser intermitente, con la notable excepción de la asociada a
la endocarditis que es constante, por esto es indispensable que se realicen más
de un grupo de cultivos. La sangre debe
tratarse contra la coagulación en el tubo de transporte o en el medio de
cultivo mismo.
En
ausencia de pruebas macroscópicas de crecimiento, debe llevarse a cabo un
subcultivo rutinario de la botella aeróbica entre 6 y 18 horas después, inoculando la mezcla de sangre-caldo en agar sangre y agar chocolate
incubando a 35° C, en una atmósfera de
CO2 al 5-10% durante 48 horas.
Material para la práctica
1 frasco con medio
de cultivo Ruiz Castañeda.
1 Jeringa estéril
de 10 ml.
1 Ligadura.
Torundas con
alcohol etílico al 70 %.
Mechero de Bunsen.
167
Método
Se debe hacer uso
de equipo estéril y técnicas asépticas apropiadas
1.- Aplicar una ligadura en el tercio medio del
brazo seleccionado.
2.- Localizar por
inspección y palpación la vena cubital intermedia a nivel del pliegue anterior
de la articulación del codo.
3.- La piel debe
ser limpiada con tintura de yodo al 2 % en círculos que se irán ensanchando
desde el sitio propuesto para la punción. El exceso de yodo se elimina con
alcohol etílico al 70 %.
4.- Realizar la
punción en la vena cubital extrayendo sangre para asegurarse de que la punción
sea correcta.
5.- Retirar la
ligadura.
6.- Extraer por lo
menos 10 ml de sangre para inocularse en frascos estériles con medio de cultivo
para aerobios y anaerobios, 5 ml de sangre respectivamente. La muestra para el
medio bifásico (agar sólido y medio líquido) Ruiz Castañeda, será de 3 ml para
efecto de la práctica.
7.- Retirar la
tapa metálica de rosca del medio Ruiz Castañeda.
8.- Con la jeringa
que contiene la muestra de sangre, hacer una perforación en la tapa de goma,
para depositar la muestra en el medio Ruiz castañeda.
9.- Agitar el
frasco lentamente, durante 10 segundos.
10.- Colocar el
frasco en posición horizontal durante 30 minutos, para que la muestra quede en
contacto con la parte sólida del medio de cultivo.
11.- Enderezar el
frasco e incubar a 37° C.
12.- Observar cada
24 horas.
Interpretación
En el medio sólido
el resultado es positivo cuando hay crecimiento colonial.
En el medio
líquido el resultado es positivo cuando es de aspecto turbio.
168
Nota
En caso de resultados positivos, los medios de
cultivo se deben conservar en incubación para resembrar posteriormente en
medios selectivos y a partir de estos últimos hacer pruebas bioquímicas para la
identificación de género y especies patógenas.
Cuestionario.
1.- ¿Cuales son
las indicaciones para realizar
hemocultivos?
2.- ¿Cuántos
hemocultivos indicaría Usted en caso de septicemia?
3.- Mencione en
orden de importancia a las 8 especies bacterianas que se aíslan con mayor
frecuencia en los hemocultivos.
4.- Describa la
técnica para la toma de la muestra.
5.- Describa la
técnica para la siembra en el medio Ruiz Castañeda.
169
Práctica No. 14
RESIEMBRA
EN MEDIOS SELECTIVOS
Objetivos
1.- El alumno
conocerá a los géneros y especies bacterianas capaces de producir bacteriemias,
septicemias y shock séptico.
2.- El alumno
conocerá los medios de cultivo selectivos útiles para el aislamiento de los
microorganismos que con mayor frecuencia producen bacteriemias, septicemias y
shock séptico.
3.- El alumno
conocerá el fundamento de la selectividad de los medios de cultivo.
4.- El alumno
sembrará con técnica de aislamiento en los medios de cultivo agar chocolate,
agar S110, agar EMB, agar Mc Conkey y agar Biggy a partir de cultivos puros.
5.- El alumno
interpretará y reportará por escrito las características morfológicas
coloniales de los cultivos positivos.
6.- El alumno
aplicará la técnica de tinción de Gram a partir de los cultivos positivos.
7.- El alumno
reportará por escrito las características morfológicas y de tinción de las
observaciones al microscopio de luz.
170
Introducción
Los
hemocultivos como medios generales o enriquecidos permiten el crecimiento de un
gran número de microorganismos sin embargo, el aislamiento definitivo de un
microorganismo bacteriano en un cultivo puro representa un serio problema
tomando en cuenta que cada uno de estos microorganismos requiere de un ambiente
en el cual se encuentren los elementos mínimos necesarios para su desarrollo,
evitando a la vez el crecimiento de otros géneros bacterianos. Para tal efecto se dispone de
varios métodos.
A diferencia de los
microorganismos que se multiplican con gran facilidad en los medios líquidos
enriquecidos como el hemocultivo, caldo con cerebro corazón, extractos de carne
etc., las bacterias que crecen sobre o dentro de un medio sólido, se encuentran
relativamente inmóviles, por consiguiente, si algunas de estas bacterias se
coloca en un medio gelificado, cada una crece y da origen a un colonia aislada.
Por lo anterior, el Gel ideal para la
mayor parte de medios de aislamiento selectivo es el Agar, al que se le adicionan
elementos nutritivos especiales para el crecimiento de algunos géneros
bacterianos.
El crecimiento de organismos no
deseados se puede inhibir utilizando algunas substancias como el azul de
metileno, sales biliares, altas
concentraciones de cloruro de sodio, etc. La técnica de
siembra usada (generalmente por estría cruzada) y el medio de cultivo seleccionado dependen del
microorganismo a investigar.
Tomando
en cuenta que los microorganismos que aíslan con mayor frecuencia en los
hemocultivos son: Staphylococcus
epidermidis, Staphylococcus aureus, Estreptococos
viridans, Enterococcus,
incluyendo Enterococcus feacalis,
Bacterias entéricas Gram negativas como Escherichia coli, Salmonella tiphy, Brucellas, Klebsiella
pneumoniae, Pseudomona aeruginosa, Diplococcus
pneumoniae, H. influenzae, Cándida, etc., los medios de cultivo
útiles para tal fin son:
·
El Agar S110, es un medio selectivo para S. aureus porque es capaz de soportar
concentraciones de cloruro de sodio, de hasta 9 %, que inhiben el crecimiento
de otras bacterias tanto Gram positivas como Gram negativas.
·
El Agar Sal manitol con rojo de
fenol es un medio altamente selectivo para
Staphylococcus aureus único
en su género que tiene la capacidad de fermentar manitol y cambiar la
coloración del medio de rojo normal, a amarillo, cuando hay producción de
ácido, como resultado de la degradación de
este carbohidrato., este cambio de coloración se debe al indicador de Ph
rojo de fenol.
171
·
El
Agar sangre de carnero es un medio selectivo para Streptococcus beta hemolíticum, en este medio de cultivo se
evidencian sus reacciones hemolíticas
observándose la beta hemólisis como un halo completamente transparente
alrededor o por debajo de las colonias.
·
El Agar sangre se recomienda para el
aislamiento de Streptococcus pneumoniae, la alfa hemólisis que producen estos
microorganismos se observa como un halo verdoso alrededor de las colonias del
medio. Es necesario hacer pruebas complementarias como la lisis bacteriana con
desoxicolato o bilis de buey así como la tinción de cápsula con tinta china.
·
El
Agar chocolate se utiliza como medio
selectivo para el aislamiento de Haemophylus influenzae, estos
microorganismos requieren de los factores V y X de la sangre para su
crecimiento. El Agar sangre humana o de cordero inhiben el crecimiento de Haemophylus.
Los microorganismos típicos son cocobacilos Gram negativos con cápsula, de 1.5
micras de largo por .5 micras de diámetro
·
Agar Sabouraud glucosado.- Con
este medio de cultivo es posible estudiar a un gran número de infecciones
causadas por hongos, contiene, glucosa,
Agar, y peptona, el medio puede contener 20 unidades de penicilina o 40
microgramos de estreptomicina o bien 50 microgramos de cloranfenicol por cada
mililitro que inhiben el crecimiento de bacterias tanto Gram positivas como
Gram negativas aerobias o anaerobias,
inhiben también el crecimiento de algunos hongos como Aspergillus
y Cryptococcus, por lo que
pueden utilizarse otros medios como Agar de papa glucosado, Agar harina de
maíz, etc.
La familia enterobacteriaceae
(bacterias entéricas), está formada por un grupo heterogéneo de
bastoncillos Gram negativos que residen de manera natural en el tubo digestivo
del hombre. En esta gran familia Enterobacteriaceae se han incluido a mas de 20 géneros y 100
especies, los géneros Escherichia,
Shigella, Salmonella, Enterobacter, Klebsiella, Serratia, Proteus, Pseudomonas son capaces de producir septicemias
mortales.
Para la identificación
preliminar de los géneros de esta gran familia, se recurre a la observación de las características
morfológicas de sus colonias aisladas en medios selectivos como:
·
Agar Mac Conkey.- Se emplea para el aislamiento de las
especies patógenas de organismos coliformes. La inhibición de bacterias Gram
positivas se obtiene mediante la mezcla de sales biliares a este medio. El Agar
Mac Conkey es un medio selectivo para el aislamiento de enteribacterias Gram
negativas.
172
·
Eosina y azul de metileno. Este medio es útil para el
aislamiento y diferenciación de los bacilos entéricos Gram negativos. El
colorante Azul de metileno inhibe el crecimiento de otros organismos.
·
El Agar SS, para Salmonellas y Shigellas es un medio
selectivo y diferencial para el aislamiento de bacilos entéricos patógenos,
especialmente para los géneros Shigella
y Salmonella. La inhibición de los organismos Gram positivos
se logra con más éxito con la mezcla de sales biliares que contiene este medio.
Material
1 Medio de cultivo
Ruiz Castañeda, previamente inoculado
(práctica anterior).
1 Medio de cultivo
Agar sangre.
1 Medio de cultivo
Agar chocolate.
1 Medio de cultivo Agar S110.
1Medio de cultivo
EMB
1 Medio de cultivo con Agar Biggy
Asa bacteriológica.
Mechero de Bunsen.
Método
·
Tomar una asada de
una de las colonias que desarrollaron en el medio sólido del medio Ruiz
Castañeda y sembrar con técnica de
aislamiento en los medios de cultivo:
Agar sangre
Agar chocolate
Agar S110
Agar EMB
Se debe tomar una asada
para sembrar en cada uno de los medios de cultivo especificado. En el caso de que
no hubiera crecimiento en la fase sólida pero en la fase líquida hubiese
indicios de desarrollo bacteriano, se procederá de la misma forma para sembrar
en los medios de cultivo.
· Incubar a 37 ° C.
· Observar los resultados cada 24 horas.
173
·
Los medios de
cultivo Agar sangre y S110 deberán mantenerse en refrigeración después de 24
horas para que se encuentren en buen estado para que en la siguiente práctica
se realice una tinción de Gram y las
pruebas bioquómicas pertinentes para la identificación del género y especie
bacteriana.
·
Los medios de
cultivo Agar chocolate y EMB deben incubarse a 37° C. Durante 48 horas para
observar el crecimiento bacteriano. Una realizada la descripción de la
morfología colonial, los cultivos deberán de mantenerse en refrigeración para
continuar con los procedimientos de
identificación de géneros y especies por pruebas bioquímicas en la próxima
sesión.
174
Cuestionario.
1.- ¿Qué es una
septicemia?
2.- ¿Cuál es la
diferencia entre bacteriemia y septicemia?
3.- Mencione a los
géneros y especies de bacterias Gram positivas que se aíslan con mayor
frecuencia en pacientes sépticos?
4.- Mencione a los
géneros y especies de bacterias Gram negativas que se aíslan con mayor
frecuencia en pacientes sépticos?.
5.- Explique el fundamento de la selectividad del medio de
cultivo agar Sangre.
6.- Explique el fundamento de la selectividad del medio de
cultivo agar Chocolate.
7.- Explique el fundamento de la selectividad del medio de
cultivo agar S 110.
8.- Explique el fundamento de la selectividad del medio de
cultivo agar EMB.
9.- ¿Qué
microorganismos se pueden aislar en el medio de cultivo Biggy?
10.- Describa la
técnica de aislamiento también llamada estría cruzada.
175
Práctica 15
IDENTIFICACIÓN
DE GENEROS Y ESPECIES BACTERIANAS POR PRUEBAS BIOQUIMICAS.
Objetivos
1.- El alumno conocerá el fundamento bioquímico de las reacciones
positivas en los medios de cultivo sólidos TSI, SIM, LIA, MIO, Agar citratado
de Simmons.
2.- El alumno conocerá el fundamento bioquímico de las reacciones
positivas en el medio de cultivo líquido Caldo con urea o en el medio sólido
Agar con urea de Christensen.
3.- El alumno aplicará las técnicas de siembra en tubos para los medios
de cultivo sólidos TSI, SIM, LIA, MIO, Agar citratado de Simmons y agar con
urea de Christensen de las colonias aisladas por resiembra, a partir del
hemocultivo.
4.- El alumno aplicará la técnica de siembra en tubos para el medio de
cultivo líquido Caldo con urea de las colonias aisladas por resiembra, a partir
del hemocultivo.
5.- El alumno interpretará las pruebas positivas y reportará a los
géneros y especies bacterianas identificadas como posibles patógenas.
176
Una vez obtenidos los cultivos puros
en medios selectivos a partir del hemocultivo, se deben realizar pruebas
bioquímicas para la identificación de los géneros y especies patógenas
aisladas. La elección de las pruebas bioquímicas y los medios de cultivo
diferenciales dependen del microorganismo en estudio.
Las características morfológicas de
las colonias en el medio de cultivo selectivo en el que hubo crecimiento así
como las características morfológicas a la
tinción de Gram de los microorganismos, son la base para el inicio de un
protocolo para la diferenciación de género y especie de bacterias Gram
positivas o Gram negativas, aerobias, anaerobias, etc.
Pruebas para la
identificación del género Streptococcus
En
Agar sangre, las colonias son redondas de 0.5 a 2.0 mm de diámetro, pueden ser mucoides, mate o
lustrosas. Las colonias mucoide
contienen material capsular formado con ácido hialurónico, que da a la colonia un aspecto húmedo, brillante y
suave. Las colonias lustrosas son mas
pequeñas, lisas y brillantes. Las colonias mate tienen apariencia opaca
y rugosa.Crecen de
forma óptima a 37º C y en pH.
7.4, en Agar sangre y producen alfa o
beta hemólisis.
Streptococcus B hemolíticus.- A
la tinción de Gram tienen forma de cocos, forman, pares o
cadenas, los cocos individuales son
esféricos, son Gram positivos y miden de 0.5 a 1
micra de diámetro son, anaerobios facultativos, producen beta hemólisis,
son acidógenos, acidofílicos, fermentadores de glucosa y maltosa.
Estas tres últimas carácterísticas
son la base de las pruebas bioquímicas para la identificación de especie, se realizan en caldos que contienen un
carbohidrato específico para su metabolismo mas un indicador de pH, el Rojo de
fenol, en las pruebas positivas, estos medios de color rosa intenso a rojo,
viran al color amarillo debido a la acidez que produce la fermentación ácida de
estos carbohidratos, de ahí los términos acidógenos y acidófilos.
Pruebas para la identificación de Staphylococcus aureus
Las colonias de S. Aureus en S110 son
redondas de 1 a
2 milímetros
de diámetro, lisas, convexas y resplandecientes ser de color amarillo dorado,
verdosas o blancas. A la tinción de Gram los estafilococos
son células esféricas de una micra de diámetro aproximadamente, distribuidas en
grupos irregulares semejantes a racimos de uvas, en cultivos líquidos se
encuentran también cocos aislados, en pares, en tetradas o en cadenas. Los
cocos jóvenes son Gram positivos.
177
S. aureus puede ser
aislado selectivamente, en el medio de cultivo Agar Sal con Manitol debido a su capacidad de
producir manitolasa, enzima que degrada al manitol (manosa), carbohidrato que
utiliza para su metabolismo, acidificando el medio de cultivo, reacción en la
que se observa un cambio de coloración del medio de cultivo, de rosa intenso a
amarillo, gracias al rojo de fenol que se adiciona al medio como indicador de
pH.
Prueba
de la catalasa.- Staphylococcus aureus
produce catalasa, enzima que convierte el peróxido de hidrógeno (agua oxigenada
H2O2) en agua y oxígeno, este último se identifica
por la liberación de burbujas al adicionar agua oxigenada a las colonias
cultivadas en S110 o en Agar sal manitol.
Prueba de la coagulasa (factor de
patogenicidad).- Staphylococcus aureus produce coagulasa, proteína de
tipo enzimático que coagula el plasma humano oxalatado o citratado (ver pag.
17, práctica No. 2 en módulo de Piel y músculo esquelético)
Pruebas para la identificación de Streptococcus
pneumoniae
En los medios de cultivo Agar
sangre con soya tripticasa, infusión cerebro corazón enriquecido con el 5%
sangre desfibrinada, después de 24 horas de incubación se observan colonias
circulares, brillantes, convexas y mucoides de 1 a 4 milímetros de
diámetro que desarrollan mas tarde una meseta central con bordes elevados
produciendo alfa hemólisis. El Agar sangre requiere de un pH de 7.4 a 7.8, concentraciones
elevadas de CO2 y temperatura óptima de 35 a 37° C. Para su
crecimiento.
Los
neumococos son cocos Gram positivos, de
forma oval o esférica, que miden de 0.5 a 1.25 micras de diámetro. Los diplococos
típicos suelen observarse en Agar sangre en forma de cocos aislados, en
pares o formando cadenas, poseen una
cápsula formada por polisacáridos que permiten una fácil tipificación por lisis
con sales biliares o con antisueros específicos.
La fermentación de la
glucosa es una prueba bioquímica que permite la tipificación de Streptococcus pneumoniae. En caldo
glucosado produce ácido láctico como producto final de la glucosa, la acidez se
evidencia por el cambio de color del medio de rosa intenso a amarillo gracias
al indicador de pH Rojo de fenol. Son catalasa
y peroxidasa negativos. La técnica de tinción. de cápsula con tinta china es otra prueba
definitiva para la midentificación de género. (ver práctica 6 páginas 86 a 93 del módulo Aparato
Respiratorio)
178
Pruebas para la identificación de Haemophylus influenzae
El Agar chocolate permite su aislamiento
selectivamente por las necesidades que
tienen estas bacterias de los factores V y X de la sangre. En este medio las
colonias requieren de 36 a
48 horas de incubación para su desarrollo. Las colonias son relativamente
pequeñas con diámetro aproximado de un milímetro, son redondas, convexas e
iridiscentes. A la tinción de Gram ,los microorganismos típicos son cocobacilos
Gram negativos con cápsula, de 1.5 micras de largo por .5 micras de diámetro.
Identificación de géneros y especies de la Familia Enterobacteriaceae
La familia Enterobacteriaceae (enterobacteriáceas), está formada por un
grupo heterogéneo de bastoncillos Gram negativos cuyo hábitat natural es el
tubo digestivo del hombre y animales. Dentro de la familia Enterobacteriaceae se han
incluido a mas de 20 géneros y 100 especies, se encuentran entre otros, a
los géneros Escherichia, Shigella,
Salmonella, Enterobacter, Klebsiella, Serratia, Proteus, etc., que se pueden aislar del hemocultivo.
Las Enterobacteriáceas son anaerobias o aerobias facultativas,
fermentan gran cantidad de carbohidratos, poseen estructuras antigénicas
complejas, producen toxinas y otros factores de virulencia.
La
familia de Enterobacteriáceas se
caracteriza desde el punto de vista bioquímico por la capacidad de algunos de
sus miembros de reducir nitratos a nitritos, de fermentar glucosa con
producción de ácido o gas, o ambos y son negativos a la oxidasa.
Para facilitar la identificación de
estos bacilos entéricos patógenos, se dispone de tres medios de cultivo, TSI,
SIM y Agar con urea, que resultan ser diferenciales por algunas reacciones
bioquímicas que se producen como resultado del metabolismo bacteriano
específico, no solo de género, sino también de especie.
Las pruebas
bioquímicas que pueden ser demostrables en estos medios son:
·
Metabolismo o fermentación de hidratos de
carbono como glucosa, sacarosa, lactosa, manitol, etc., La reacción de
fermentación se evidencia por un cambio de color, de rojo normal del medio de
cultivo por la adición al medio de Rojo de fenol, indicador de pH., al color
amarillo que se produce por la acidificación del medio por acción de los ácidos láctico o pirúvico.
179
·
La producción de sulfuro ferroso que se demuestra por el
ennegrecimiento del medio de cultivo. En
esta reacción se produce sulfuro ferroso a partir del aminoácido cisteína o de
tiosulfato sódico que contiene el medio de cultivo. En la primera etapa el
tiosulfato o la cisteína son reducidos con la participación de las enzimas
cisteína o tiosulfato desulfhidrasas para formar ácido sulfhídrico (H2S) mas
amoníaco (NH3), en la segunda etapa el ácido sulfhídrico (H2S) reacciona con la sal fuerte que contiene el
medio de cultivo, citrato de amonio férrico, para formar sulfuro ferroso que
produce un precipitado de color negro en el medio.
·
Producción de Indol, se produce a partir del triptófano que se
encuentra en las peptonas del medio de cultivo TSI. El triptófano puede ser
oxidado por la acción de enzimas bacterianas, las triptofanasas, que dan origen
a tres productos indólicos, Indol, escatol y ácido indolacético en reacciones
bioquímicas específicas. La desaminación del triptófano produce Indol que se
demuestra adicionando unas cuantas gotas del reactivo de Kovac o de Ehrlich al
medio, formándose un anillo de color rojo en la parte superior del medio de
cultivo.
·
Movimiento bacteriano conferido por flagelos, cuando el medio SIM es
inoculado por punción cuidadosamente con el asa recta, las cepas móviles crecen
lejos del sitio de la inoculación.
·
La ureasa es una enzima bacteriana capaz de
hidrolizar a la urea formando dos
moléculas de amoníaco que finalmente es convertido en carbonato de amonio,
estos compuestos derivados de la urea alcalinizan el medio de cultivo que
cambia de color de rosa tenue (durazno) a rojo por el indicador de pH rojo de fenol .
TSI Agar con tres azúcares y hierro.- TSI es un medio de cultivo sólido en tubos inclinados con pico de
flauta, el medio es de color rojol por
el indicador de pH rojo de fenol, contiene lactosa en la superficie, sacarosa y
glucosa en el fondo del tubo. El agar con tres
azucares y hierro lo ideó Hajna para
diferenciar los bacilos entéricos Gram
negativos por su habilidad para atacar la glucosa, lactosa y sacarosa y liberar
sulfuros.
TSI.-
Fórmula en Gramos por Litro de Agua Destilada
Polypeptone…………………. 20.0 Cloruro de Sodio …………… 5.0
Lactosa…………………...…... 10.0 Sacarosa……………………... 10.0
Glucosa……………………........ 1.0 Sulfato de Amonio Ferroso …...
0.2
Tiosulfato de Sodio…………… 0.2 Rojo de Fenol………………... .. 0.025
Agar.
……………………………13.0 pH final
7.3 +
180
Preparación
Se suspenden los 59.4 gramos del polvo
en un litro de agua destilada. Mézclese bien y caliéntese agitando de vez en
cuando. Hiérvase durante 1 ó 2 minutos para disolver. Distribúyase en tubos de
ensayo, llenándolos hasta su tercera parte. Esterilícese a no más de 118°C durante 15 a 17 minutos. Los tubos se
deben enfriar en posición inclinada, de tal manera que produzcan fondos
profundos con pico de flauta.
Técnica de siembra
El Agar TSI inclinado se debe inocular a partir
de las colonias seleccionadas como EMB,
Agar Mc Conkey o de otras fuentes apropiadas. EL cultivo se debe estriar en la
porción inclinada y picar hasta un centímetro antes del fondo. Los cultivos se
leen después de 18 a
48 horas de incubación a 37° C.
Metabolismo de
Carbohidratos.- Fundamento.- El metabolismo bacteriano de alguno o de los tres
carbohidratos da como resultado la producción de ácido pirúvico y ácido láctico
(fermentación ácida), por lo que medio de cultivo se acidifica, esta acidez se
evidencia por un cambio de color del medio de rojo o rosa intenso al color
amarillo por la acción del indicador rojo de fenol. Si el medio se conserva
alcalino no hay cambio de color, conservándose el medio de cultivo de color
rojo.
Escherichia coli fermenta los tres
azúcares por lo que todo el medio de cultivo, tanto el pico de flauta como el
fondo, cambiarán al color amarillo.
El
género Salmonella fermenta glucosa pero no lactosa, por lo que el pico
de flauta permanece rojo, pero el fondo será de color amarillo.
Producción de Sulfuro ferroso en
TSI.-Fundamento.- Algunas bacterias son capaces
de degradar aminoácidos azufrados como cisteína y metionina, o de
utilizar tiosulfato como sustrato, liberando el azufre de estos compuestos para
formar ácido sulfhídrico H2S en forma gaseosa gracias a la acción de enzimas
bacterianas como la cisteína desulfhidrasa y tiosulfato reductasa, este medio contiene Sulfato de Amonio Ferroso y Tiosulfato de
sodio, este último es el primer sustrato
que utiliza la
enzima tiosulfato reductasa bacteriana para formar ácido sulfhídrico incoloro el cual reacciona
posteriormente con el Sulfato de Amonio Ferroso para formar sulfuro ferroso que
forma un precipitado negro en el medio. Las especies del género Proteus
y Salmonella producen sulfuro ferroso que se evidencia por un
precipitado de color negro en el medio. E. Coli y Shigellas son
negativas.
181
SIM Azufre Indol y
movimiento .- Medio de cultivo sólido en tubos de color ligeramente ámbar
transparente. Se emplea para la determinación de la producción de sulfuro
ferroso, formación de Indol y movimiento de enterobacterias.
Fórmula en gramos por litro de agua destilada
Trypticase.................................20.0
grs. Thiotone
(peptonas)........... 6.1 grs.
Sulfato de hierro y
amonio......... 0.2 grs. Tiosulfato de sodio.....…...... 0.2 grs.
Agar................…..................... 3.5
grs. pH final 7.3 +
Preparación
Se suspenden los 30 gramos del material
seco en un litro de agua destilada, mézclese bien y cuando se obtenga la
suspensión uniforme, caliéntese agitando de cuando en cuando y hiérvase durante
un minuto o hasta su disolución. Distribúyase
en tubos de ensayo, llenándolos hasta su tercera parte. Esterilícese a 121°C a 15 libras de presión
durante 15 minutos
Técnica de siembra
El Agar SIM se debe inocular por picadura en el centro hasta la mitad o
un centímetro antes del fondo. Las muestras se toma de las colonias seleccionadas como EMB, Agar Mc Conkey
Sulfuro ferroso.- Fundamento.- Algunas bacterias son capaces de
degradar aminoácidos azufrados como cisteína y metionina, o de utilizar
tiosulfato como sustrato, liberando el azufre de estos compuestos para formar
ácido sulfhídrico H2S en forma gaseosa gracias a la acción de enzimas
bacterianas como la cisteína desulfhidrasa y tiosulfato reductasa.
Este medio
contiene Sulfato de Amonio Ferroso y Tiosulfato de sodio, este último es el primer sustrato que utiliza
la enzima
tiosulfato reductasa bacteriana para formar
ácido sulfhídrico incoloro el cual reacciona posteriormente con el Sulfato de Amonio Ferrico que contiene el medio de cultivo para formar sulfuro ferroso que
forma un precipitado negro en el medio.
Las especies del género Proteus
y Salmonella producen sulfuro ferroso que se evidencia por el color
negro del medio. Escherichia coli y Shigellas no
producen H2S por lo que el medio conserva su color original.
182
Indol.- Fundamento.- El alto contenido de trypticase
(triptófano) en el medio SIM, lo hace ideal para la producción de indol. El
triptófano puede ser desaminado o descarboxilado por la acción de la enzima
triptofanasa que producen algunas bacterias utilizando como coenzima al fosfato
de piridoxina (vitamina B6) dando origen a tres metabolitos indólicos (indol,
escatol y ácido indolacético) por reacciones específicas de la enzima, liberando una molécula de amoniaco.
La desaminación del triptófano
produce Indol. La inmediata aparición de un anillo de color rojo cuando
se agregan cinco gotas del reactivo de Kovac (Alcohol amílico o butílico
+ Dimetilaminobenzaldehído + HCL concentrado) al medio de cultivo incubado
durante 24 horas indica la presencia de Indol y se considera una prueba
positiva. Eschericia coli es capaz de
producir Indol por lo que al agregar 5 gotas del reactivo de de Kovac, se forma un anillo rojo en la superficie del medio SIM.
Movimiento positivo en el medio SIM.- Gracias a sus flagelos perítricos los
géneros Salmonella, Proteus, Escherichia coli se desplazan alejándose de
la picadura dando un aspecto de remolino o turbidez alrededor de la
picadura.
Los géneros Klebsiella y Shigella no tienen movimiento.
LIA.- Agar lisina con
hierro. Medio sólido en tubos con pico de flauta de
color rosa.
·
Determina si los miembros de la familia
Enterobcteriaceae descarboxilan o
desaminan la lisina.
·
Ayuda en la identificación de especies de Salmonella
la mayoría de la cuales son H2S positivas y lisina
positivas.
Fórmula en gramos por
litro de agua
Agar ....................................15.0 g Peptona de gelatina...........
5.0 g
Extracto de levadura..............3.0 g
Glucosa...............................1.0 g
L-lisina.................................. 1.0 g Citrato férrico-amónico........
0.5g
Tiosulfato de sodio anhidro... 0.4 g Púrpura de
bromocresol..........2.0 mg
Agua destilada................ 1000 ml pH final: 6,7 + 0,2
Fraccionar en cantidades de 4 ml. (tubos para la prueba 13 X 100 mm ).
Agar inclinado extremo inferior profundo, (
anaerobio) con pico de flauta corto.
183
Técnica de siembra.- Con el asa bacteriológica recta, estriar el
pico de flauta y punzar el fondo del medio dos veces. Dejar las tapas del medio
de cultivo ligeramente flojas. Incubar durante 18 a 24 hrs., a 35° C.
Descarboxilación de la lisina.- La descarboxilación es el proceso
por el cual las bacterias que poseen enzimas descarboxilasas, atacan a los
aminoácidos en su carboxilo terminal (COOH) para formar una amina o una diamina
y CO2.
R-CH-NH2- COOH ----> R-CH2-NH2 + CO2
aminoácido amina dióxido de carbono
aminoácido amina dióxido de carbono
Existen numerosas enzimas descarboxilasas
utilizadas para la identificación bacteriana, las tres mas importantes son lisina,
ornitina y arginina descarboxilasas.
Estas descarboxilasas son enzimas
adaptativas o inducidas y solo se activan
cuando un microorganismo es cultivado en un ambiente ácido en presencia
de un sustrato especifico. Los productos de la descarboxilación de estos
aminoácidos cambian el pH a limites alcalinos.
La descarboxilación que producen estas enzimas, esta restringida a los
aminoácidos que poseen por lo menos un grupo químicamente activo
distinto de una amina como (NH2) y a los aminoácidos que tienen un grupo
carboxilo (COOH).
Este tipo de descarboxilación ocurre en
anaerobiosis, es decir, cuando en la glicólisis se obtienen lactato y piruvato
como productos finales que acidifican el medio de cultivo y activan a las
enzimas descarboxilasas. La descarboxilación es irreversible no oxidativa y por
lo general requiere una coenzima común, fosfato de piridoxal, que refuerza la actividad de las
descarboxilasas. El aminoácido L-lisina
es descarboxilado para formar cadaverina, una diamina y dióxido de carbono, por
la acción de la enzima especifica lisina descarboxilasa.
El aminoácido L-
ornitina es descarboxilado por la enzima ornitina descarboxilasa para formar la
diamina putresina y dióxido de carbono.
184
Todos los
integrantes de la familia Enterobacteriaceae causan una fermentación inicial de la glucosa
con producción de ácidos que originan un cambio en el indicador de pH del
púrpura al amarillo en el curso de las primeras 10 a 12 hrs. de incubación. En
respuesta a la acidez, los microorganismos que producen lisina
descarboxilasa forman una amina,
cadaverina, que alcaliniza al medio de cultivo, manifestándose por un nuevo viraje del indicador de pH
púrpura de bromocresol, a la alcalinidad (color púrpura).
Interpretación
de la descarboxilación de la lisina
Positivo (+): El pico de flauta se observa de
color púrpura (alcalino) y el extremo inferior púrpura (alcalino), puede
haber producción de ácido sulfhídrico (H2S) o sin el.
Negativo (-) pico de flauta púrpura y el extremo
inferior amarillo (ácido) que indica solo la fermentación de la glucosa sin
descarboxilación de la lisina.
La reacción de
descarboxilación en el extremo inferior (púrpura), puede enmascararse por el
color negro del sulfuro ferroso a partir del H2S
que producen algunas bacterias. La producción de H2S se produce en
un medio alcalino (púrpura).
Producción de sulfuro ferroso en LIA. Algunas
bacterias son capaces de degradar
aminoácidos azufrados como cisteína y metionina, o de utilizar tiosulfato como
sustrato, liberando el azufre de estos compuestos para formar ácido sulfhídrico
H2S en forma gaseosa gracias a la acción de enzimas bacterianas como la
cisteína desulfhidrasa y tiosulfato reductasa, este medio
contiene Sulfato de Amonio Ferroso y Tiosulfato de sodio, este último es el primer sustrato que utiliza
la enzima
tiosulfato reductasa bacteriana para formar
ácido sulfhídrico incoloro el cual reacciona posteriormente con el Sulfato de Amonio Ferroso para formar sulfuro ferroso que forma un precipitado negro en el medio
MIO
(Motility-Indole-Ornitine
o Motilidad-Indol-Ornitina).- Esta prueba bioquímica permite identificar
bacterias de acuerdo a su motilidad a la producción de Indol y a la
descarboxilación de la ornitina.
Fórmula en gramos por
litro:
Dextrosa...........................1.0 grs. Extracto de
levadura.................3.0 grs.
Peptona............................10.0
grs.
Tripteína..................................10.0 grs
Clorhidrato de Ornitina........5.0 grs. Agar..........................................2.0
grs.
Púrpura de bromocresol........0.02 grs. pH
final: 6.5 ± 0.2
185
Los tubos se
siembran por punción con asa recta hasta un centímetro antes del fondo. Incubar por 24 horas a 37° C.
Movilidad. La movilidad se demuestra por un enturbiamiento del medio o un
crecimiento que se difunde desde la línea de inoculación, mientras en las no
móviles crece a lo largo de la línea de siembra.
Indol.- Fundamento.- El
triptófano que contiene el medio MIO puede ser desaminado o descarboxilado por
la acción de la enzima triptofanasa que producen algunas bacterias, utilizando
como coenzima al fosfato de piridoxina (vitamina B6) dando origen a tres
metabolitos indólicos (indol, metilindol y ácido indolacético) y liberando una
molécula de amoniaco. La desaminación del triptófano produce Indol. La inmediata
aparición de un anillo de color
rojo cuando se agregan cinco
gotas del reactivo de Kovac (Alcohol amílico o butílico +
Dimetilaminobenzaldehído + HCL concentrado) al medio de cultivo incubado
durante 24 horas, indica la presencia de Indol. La prueba
de indol se realiza una vez que se ha determinado la movilidad bacteriana.
Descarboxilación de la ornitina.- La descarboxilación es el proceso
por el cual las bacterias que poseen enzimas descarboxilasas atacan a los
aminoácidos en su carboxilo terminal (COOH) para formar una amina o una diamina
y CO2.
R-CH-NH2-COOH -> R-CH2- NH2 + CO2
aminoácido amina
dióxido de carbono
Las tres enzimas descarboxilasas bacterianas
mas importantes son lisina, ornitina y arginina descarboxilasas. Estas
descarboxilasas son enzimas adaptativas o inducidas y solo se activan cuando un microorganismo es cultivado en un
ambiente ácido en presencia de un sustrato especifico, ornitina. Los productos
de la descarboxilación de estos aminoácidos cambian el pH a limites alcalinos.
La descarboxilación que producen estas
enzimas, esta restringida a los aminoácidos que poseen por lo menos un grupo
químicamente activo distinto de una amina como (NH2) y a los aminoácidos que
tienen un grupo carboxilo (COOH). El aminoácido L- ornitina tiene esta
características y es descarboxilado por la enzima ornitina descarboxilasa para
formar la diamina putresina y dióxido de
carbono.
Todos los
integrantes de la familia Enterobacteriaceae causan una fermentación inicial de la glucosa
con producción de ácidos que originan un cambio en el indicador de pH del
púrpura al amarillo en el curso de las primeras 10 a 12 hrs. de
incubación.
186
En respuesta a la
acidez, los microorganismos que producen ornitina descarboxilasa forman una amina, putresina, que alcaliniza
al medio de cultivo, manifestándose por
un nuevo viraje del indicador de pH púrpura de bromocresol, a la alcalinidad
(color púrpura).
Este tipo de descarboxilación ocurre en
anaerobiosis, es decir, cuando en la glicólisis
se obtienen lactato y piruvato como productos finales que acidifican el
medio de cultivo y activan a las enzimas descarboxilasas.
La reacción
positiva de la ornitina está dada por un color púrpura del medio debido a la
fermentación de la glucosa que reduce el pH proporcionando condiciones óptimas
para la decarboxilación de la ornitina de la fórmula. Si ocurre la
decarboxilación de la ornitina el pH sube y el color del medio se vuelve
púrpura gracias al indicador púrpura de bromocresol. Los
cultivos negativos a ornitina producen un tubo amarillo que puede ser púrpura
en la parte superior.
SIMMONS, AGAR CITRATADO DE
El Agar Citratado de Simmons.- Medio sólido de color verde en placas
o en tubos inclinados, se usa para diferenciar las bacterias
entéricas Gram negativas, basándose en la utilización de citrato.
Fórmula en Gramos por Litro de Agua Destilada
Fosfato Monobásico de Amonio
................................................................. 1.0
Fosfato Dipotásico
...................................................................................... 1.0
Cloruro de Sodio
......................................................................................... 5.0
Citrato de Sodio
.......................................................................................... 2.0
Sulfato de Magnesio
................................................................................... 0.2
Agar
............................................................................................................ 15.0
Azul se Bromotimol
..................................................................................... 0.03
Preparación
Suspender
los 24.2 gramos
de polvo en un litro de agua destilada.
Déjese remojar durante 5
a 10 minutos.
Mezclar bien y calentar suavemente agitando de vez en cuando hasta que
el medio hierva durante 1 o 2 minutos.
Distribuyese en tubos y esterilícese en
autoclave a 121°C .
(15 libras
de presión) durante 15 minutos. Se deja
enfriar en posición inclinada, aunque también se puede emplear como medio en
placas.
187
Técnica de siembra
Se
pueden hacer cultivos en placa con técnica de aislamiento o si se prefiere el
medio inclinado, se inocula estriando la superficie y picando el fondo.
Fundamento.- Solo los organismos que utilizan
el citrato como única fuente de carbono crecen en el Agar Citratado de Simmons.
El citrato es obtenido del citrato de
sodio que contiene el medio para ser incorporado directamente al ciclo de los
ácidos tricarboxílicos (Krebs) para su metabolismo y producción de energía.
Esta reacción es catalizada por la citrato desmolasa o citratasa enzimas
bacterianas que requieren de un medio alcalino y de cationes divalentes como
magnesio para su activación.
Algunas enterobacterias son capaces
de degradar las sales de amonio (fosfato
monobásico de amonio) del medio para formar amoníaco (NH3) para
ser utilizado como fuente nitrogenada para su metabolismo. El nitrógeno liberado en forma de amoníaco es convertido en hidróxido de amonio (NH4OH) mas fosfato
orgánico, estos dos productos proporcionan las condiciones óptimas para la
activación de la citratasa que obtiene
al citrato y lo incorpora al ciclo de Krebs.
La aparición de un crecimiento bacteriano
visible indica la utilización del citrato como fuente de carbono. De manera
indirecta se comprueba por un cambio de color del medio de cultivo, del color
verde normal, al color azul que indica la alcalinización del medio por el del
indicador de pH, azul de bromotimol.
Los géneros Salmonella y Proteus generalmente sin citrato
positivas, en cambio Klebsiella, Shigellas y E.coli son negativas.
Estos productos
alcalinizan el medio de cultivo haciendo que cambie de color, de rosa tenue a
rojo por la acción del indicador Rojo de fenol.
188
Fórmula en gramos por litro de agua destilada.
Peptona............................... 1.0 gr.
Cloruro de sodio................
5.0 grs.
Fosfato monopotásico......... 2.0 grs. Glucosa
.............................. 1.0 grs.
Urea...................................20.0
grs. Rojo de
fenol.......................0.012 grs.
pH final
6.8 +
Preparación
Se pesan 3.87 grs. Para cada 100 ml de agua destilada y se disuelve sin
calentar.
Se distribuye en tubos estériles de 13 X 100 mm , en fracciones de 2 ml.
Esterilizar en autoclave de 115 a 121° C a 15 libras de presión por
15 minutos.
Déjense enfriar los tubos a 50° C y colocar en
forma inclinada.
Técnica de siembra
Se debe estriar superficialmente con un inóculo
grande, el fondo sirve como control del color, por lo que no debe puncionarse.
El
Agar con urea de Christian elimina la necesidad de que los microorganismos
utilicen el amoníaco como única fuente de nitrógeno para su metabolismo, la
glucosa que contiene el medio permite el crecimiento de un buen número de
géneros que además podrán evidenciar la producción de ureasa alcalinizando el
medio de cultivo haciendo que cambie del color normal al rojo por el indicador
Rojo de fenol. La mayor parte de
las especies del género Proteus dan una reacción fuertemente positiva a
las 24 horas de incubación. Otros géneros de bacterias paracólicas dan una
pequeña reacción positiva desde las 6 primeras horas de incubación que se
intensifica hasta 4 cruces hasta después de tres días. Otros géneros menos
positivos a la ureasa dan una reacción leve después de 6 días.
Material
para el desarrollo de la práctica
1 juego de medios de cultivo diferenciales
para la identificación de enterobacterias, TSI, SIM, LIA, MIO, Citrato de
Simmons, Caldo urea.
1 tubo con plasma citratado.
1 frasco con peróxido de hidrógeno (H2O2)
Microscopio
Mechero de Bunsen
Asa bacteriológica.
Juego de reactivos para la tinción de Gram.
Portaobjetos y cubreobjetos.
189
Desarrollo
de la práctica
En caso de haberse desarrollado algunas colonias
en el medio de agar sangre, hacer un reporte de la morfología colonial y del
tipo de hemólisis en su caso, además, hacer un frotis para la tinción de Gram.
En caso de haber crecimiento en el medio S 110,
hacer un reporte de las características morfológicas de las colonias, hacer la
pruebas de la peroxidasa y coagulasa, hacer un frotis y tinción de Gram para la
identificación de Staphylococcus aureus.
De las colonias desarrolladas en agar EMB o Agar Mc Conkey
tomar muestras para sembrar en cada uno de los medios de cultivo
diferenciales para enterobacterias, TSI, SIM, LIA, MIO, Citrato
de Simmons, Caldo urea.
Interpretar los resultados, compararlos con
la tabla de pruebas bioquímicas por géneros y especies.
Analizar y discutir el diagnóstico con su
asesor.